
 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
分析 (1)因为该燃料含C、H、O三种元素,故燃烧产物为CO2和H2O,由题意可知U形管增加的质量为吸收水的质量,广口瓶增加的质量为生成的CO2质量,生成的正盐为CaCO3,根据碳原子守恒计算CaCO3的物质的量,再根据m=nM计算CaCO3的质量;
(2)根据水的分子式中H元素质量分数计算;
(3)根据碳元素守恒、结合m=nM计算二氧化碳中C元素质;
(4)由元素守恒,结合(2)(3)中的数据计算;
(5)确定氧化物中C、H原子数目之比,结合醇的每个分子中含有一个氧原子,确定该醇的分子式与结构简式.
解答 解:(1)因为该燃料含C、H、O三种元素,故燃烧产物为CO2和H2O,由题意可知U形管增加的质量为吸收水的质量:102.9g-101.1g=1.8g,
广口瓶增加的质量为生成的CO2质量:314.2g-312.0g=2.2g,CO2的物质的量=$\frac{2.2g}{44g/mol}$=0.05mol,广口瓶中生成的正盐为CaCO3,根据C原子守恒可知生成CaCO3 0.05mol,其质量为0.05mol×100g/mol=5g,
故答案为:1.8;5;
(2)生成水的质量为1.8g,水中含H元素质量为:1.8g×$\frac{2}{18}$=0.2g,
故答案为:0.2;
(3)生成CO2的物质的量为0.05mol,则生成的二氧化碳中碳元素的质量为:0.05mol×12g/mol=0.6g,
故答案为:0.6;
(4)根据C、H元素守恒,该燃料中m(C):m(H)=0.6g:0.3g=3:1,
故答案为:3:1.
(5)有机物分子中N(C):N(H)=0.05mol:$\frac{0.2g}{1g/mol}$=1:4,故有机物分子中只能有1个C原子,H原子数目为4,醇的每个分子中含有一个氧原子,故该醇的分子式为CH4O,结构简式为CH3OH,
故答案为:CH4O;CH3OH.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,注意根据有机物的燃烧法和元素守恒法是确定有机物分子式的方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
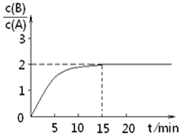 某温度下在2L密闭容器中加人一定量A,发生以下化学反应:
某温度下在2L密闭容器中加人一定量A,发生以下化学反应:| A. | 反应达平衡时,A的转化率为80% | |
| B. | A的初始物质的量为4mol | |
| C. | 反应到达平衡时,放出的热量是193kJ | |
| D. | 15min时,v正=v逆=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
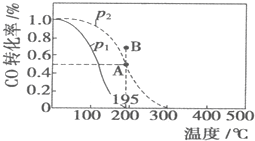 在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示
在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | P1>P2,a<0 | |
| B. | 在P2及195℃时,反应前3min的平均速率v(CH3OH)=0.08mol/(L•min) | |
| C. | 在P2及195℃时,该反应的平衡常数为25(mol/L)-2 | |
| D. | 在B点时,v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
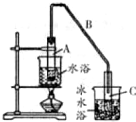 某化学小组以环己醇
某化学小组以环己醇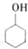 制备环己烯:已知
制备环己烯:已知| 密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
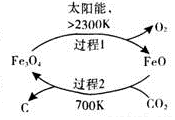 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
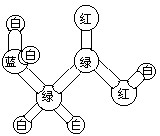 如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++H++CO32- | B. | Fe2(SO4)3=2Fe3++3SO42- | ||
| C. | MgCl2=Mg2++2Cl- | D. | NaOH=Na++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | v1mL | v2mL | 1mL | 0 | 20 | 320 |
| Ⅲ | v3mL | v4mL | v5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com