
分析 ①硫酸为二元强酸,盐酸为一元强酸,强酸完全电离,醋酸为一元弱酸,不完全电离;
②设三种酸的c(H+)为1mol/L,硫酸为二元强酸,则硫酸溶液的浓度为0.5mol/L,盐酸为一元强酸,则盐酸的浓度为1mol/L,醋酸为一元弱酸,不完全电离,则醋酸溶液的浓度大于1mol/L;
③由于醋酸存在电离平衡,加水稀释促进电离,因此c(H+)相同的三种酸均加水稀释至原来的100倍后,醋酸溶液中c(H+)最大,加入同样的锌粒,反应最快.
解答 解:①硫酸为二元强酸,盐酸为一元强酸,强酸完全电离,醋酸为一元弱酸,不完全电离,当三种酸溶液等物质的量浓度时,硫酸溶液中c(H+)是盐酸中c(H+)的2倍,醋酸溶液中c(H+)小于盐酸中c(H+),因此c(H+)最大的是硫酸,
故答案为:B;
②设三种酸的c(H+)为1mol/L,硫酸为二元强酸,则硫酸溶液的浓度为0.5mol/L,盐酸为一元强酸,则盐酸的浓度为1mol/L,醋酸为一元弱酸,不完全电离,则醋酸溶液的浓度大于1mol/L,因此溶液浓度最大的是醋酸溶液,
故答案为:C;
③由于醋酸存在电离平衡,加水稀释促进电离,因此c(H+)相同的三种酸均加水稀释至原来的100倍后,醋酸溶液中c(H+)最大,当加入同样的锌粒时,化学反应速率最快,
故答案为:C.
点评 本题考查了弱电解质的电离和化学反应速率影响因素,明确强电解质和弱电解质电离特点是解题的关键,难度不大,注意基础知识的积累.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
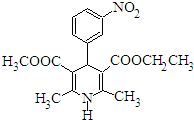 尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )| A. | 该物质的分子式为C18H20N2O6 | |
| B. | 该物质可以和银氨溶液发生银镜反应 | |
| C. | 该物质属于芳香族化合物,能溶于水 | |
| D. | 该物质在酸性条件下不发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:实验题
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
甲:Fe2O3、NO2乙:Fe2O3、NO2、O2丙:Fe3O4、NO2、O2丁:FeO、NO2、N2
(1).实验前,小组成员经讨论认定猜想丁不成立,理由是__________________.
针对上述猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):
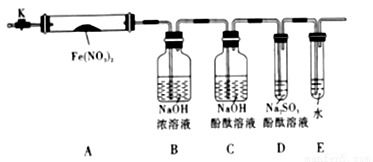
(2).实验过程
①仪器连接后,放人固体试剂之前,应______________
②称取Fe(NO3)2固体3.6g置于A中,加热前先打开K,___________,后再关闭K,用酒精灯加热
③观察到A中有红棕色气体出现,C、D中未见明显变化.
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象.
(3).实验结果分析讨论:
①根据实验现象和剩余固体的质量经分析,可初步确认分解产物中有____________。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中溶液颜色会退去;另一个同学认定分解产物中有O2存在,未检侧到的原因是_________________。
③为了验证是否有O2,某同学另称Fe(NO3)2固体3.6g,充分加热,收集气体,假设产生的气体全部收集,将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于2/3,通入一定量的O2后,气体全部被吸收,请写出Fe(NO3)2受热分解的化学方程式______________,通入O2的物质的量为_____________。
④小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。写一点不足之处:__________________________。
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列有关NH4Fe(SO4)2水溶液的叙述正确的是
A.该溶液中Mg2+、H+、NO3-、Cl-可以大量共存
B.该溶液能使碘化钾试纸变蓝,反应的离子方程式为:Fe3++2I-=Fe2++I2
C.该溶液和足量的Ba(OH)2溶液反应的离子方程式为: Fe3++SO42-+Ba2++3OH-=BaSO4↓+Fe(OH)3↓
D. 该溶液与足量铜粉 反应的离子方程式为:2Fe3++3Cu=2Fe+3Cu2+
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:选择题
化学与人类生活、能源开发、资源利用等密切相关。下列说法正确的是 ( )
A.家中做卫生保洁时,可将漂白粉与洁厕精(含浓盐酸)混合使用
B.Na2O2可作漂白剂和供氧剂,碳酸钠可用于 治疗胃酸过多
治疗胃酸过多
C.可以用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2(g)
D.施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com