
| A.CsI | B.NaF | C.LiI | D.KCl |
科目:高中化学 来源:不详 题型:单选题
| A.Y是第ⅦA族元素 | B.X是第二周期元素 |
| C.Y-与X2+的最外层电子数相同 | D.化合物XY2的化学键为离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
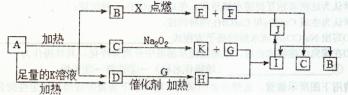
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素性质随原子序数的递增呈周期性变化的根本原因是元素的化合价呈周期性变化 |
| B.核外电子根据其能量的差别处于不同的电子层,能量越高离核越近 |
| C.所有原子的原子核都是由质子和中子构成的 |
| D.在元素周期表中具有相同的电子层数的主族元素,所处的周期序数相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原于半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:H2SiO3< H3PO4< H2SO4 | B.电负性:I >Cl> Br >F |
| C.第一电离能:N > O > C | D.沸点:H2O> H2Te >H2Se >H2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
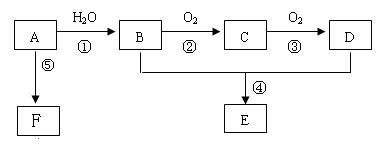
 是 。
是 。 为:
为:  _________
_________ ,相关分离操作方法是
,相关分离操作方法是  __(填名称)。
__(填名称)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X原子核外最外层电子数是次外层的2倍 |
| Y | Y的气态氢化物的水溶液显弱碱性 |
| Z | Z是地壳中含量最多的金属元素 |
| W | 常温常压下,W的单质是淡黄色固体 |
| Q | …… |
 (1)元素Q在元素周期表中的位置______________________________.
(1)元素Q在元素周期表中的位置______________________________.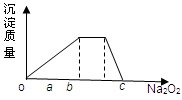
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
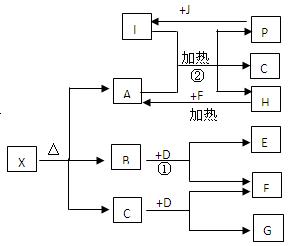
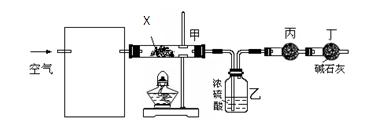
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com