
分析 (1)根据△c之比等于化学计量数之比,计算出10s内A的浓度减少量;
(2)带入v=$\frac{△c}{△t}$.
解答 解:(1)可逆反应2A(g)+B(g)?C(g),经过10s后,B的浓度降低了0.06mol•L-1,则A的浓度降低了2×0.06mol•L-1=0.12mol•L-1,因此A的起始浓度为2mol•L-1+0.12mol•L-1=2.12mol•L-1,
答:A的起始浓度为2.12mol•L-1;
(2)v(A)=$\frac{△c}{△t}$=$\frac{0.12mol•L{\;}^{-1}}{10s}$=0.012mol•L-1•s-1,
答:10s内用A的物质浓度变化表示的反应速率是0.012mol•L-1•s-1.
点评 本题考查化学反应速率有关计算,难度不大,常用定义式法与速率规律进行解答,根据情况选择合适的计算方法.


科目:高中化学 来源: 题型:解答题
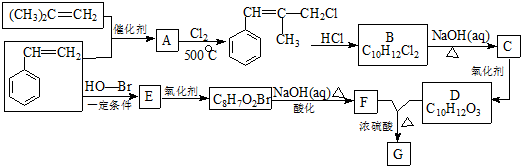
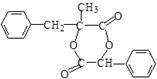 .
.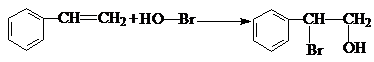 .
.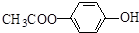 和
和 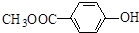 .
.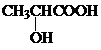 )的合成线路:
)的合成线路: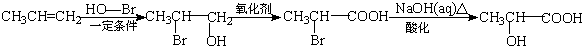 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
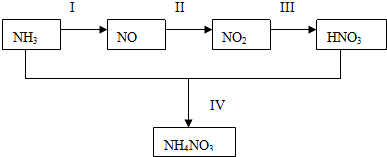
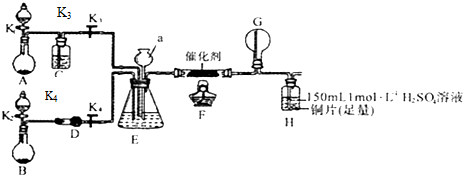
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | O3与CO2的结构相似 | |
| B. | 硫粉不溶于水,易溶于酒精,难溶于CS2中 | |
| C. | Be(OH)2是两性氢氧化物 | |
| D. | 在相同条件下,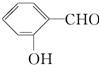 的沸点高于 的沸点高于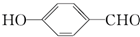 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间 | |
| B. | 化学反应达到最大限度时,正逆反应速率也达到最大且相等 | |
| C. | 用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 | |
| D. | 用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀盐酸沉淀不溶解 | |
| B. | 检验Cl-:加入AgNO3溶液出现白色沉淀 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈浅紫色 | |
| D. | 检验NH4+:滴入浓NaOH溶液后,加热,用湿润红色石蕊试纸检验产生气体发现变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酶是具有催化作用的蛋白质 | |
| B. | 酶的催化作用具有选择性和专一性 | |
| C. | 高温或重金属盐能使酶失去生理活性 | |
| D. | 酶只有在强酸性或强碱性条件下才能发挥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
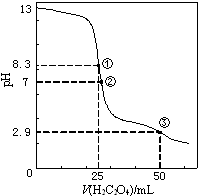 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+)+c(H+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠水解的平衡常数Kh随温度升高而减小 | |
| B. | 0.5mol•L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol•L-1醋酸钠溶液pH为n,水解的程度为b,则m<n、a>b | |
| C. | 醋酸钠的水解的平衡常数Kh=KW•Ka | |
| D. | 在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol•L-1,向其中加入固体醋酸钠,使其浓度为0.9mol•L-1,以上三种金属离子中只有Zn2+能生成沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com