
 ),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )| A. | 3:5 | B. | 1:2 | C. | 2:3 | D. | 2:5 |
分析 酯化反应是醇跟羧酸或含氧无机酸生成酯和水的反应,实质是醇脱羟基上的氢原子,酸脱羟基, 为有机物的结构简式,其中顶点省略的是C原子,每个C原子均形成4对共价键,每个O原子形成2对共价键,C原子价键不饱和的用H原子补充,分子式为:C3H4O3,结合酯化反应的本质分析解答.
为有机物的结构简式,其中顶点省略的是C原子,每个C原子均形成4对共价键,每个O原子形成2对共价键,C原子价键不饱和的用H原子补充,分子式为:C3H4O3,结合酯化反应的本质分析解答.
解答 解:酯化反应实质是醇脱羟基上的氢原子,酸脱羟基, 为有机物的结构简式,其中顶点省略的是C原子,该有机物为乙二醇
为有机物的结构简式,其中顶点省略的是C原子,该有机物为乙二醇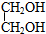 与碳酸(H2CO3)反应而得,这两种分子的原子个数比为10:6,即5:3,只有A符合,
与碳酸(H2CO3)反应而得,这两种分子的原子个数比为10:6,即5:3,只有A符合,
故选A.
点评 本题主要考查的酯化反应的应用,掌握酯化反应实质是醇脱羟基上的氢原子,酸脱羟基为解答关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯中存在的电子总数为12NA | |
| B. | 标准状况下,22.4LHF的物质的量为1mol | |
| C. | 铅蓄电池电解氯化钠溶液,得到标况下22.4L氢气,理论上铅蓄电池中消耗氢离子个数为4NA | |
| D. | lmol的Na2C03溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32- )+c(H2C03)=0.lmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:
A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子的结构示意图: | |
| B. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| C. | 氢氧根离子的电子式: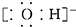 | |
| D. | NaHCO3的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molMg在空气中完全燃烧生成MgO和Mg2N3,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 酸性KMnO4溶液中通入SO2:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | AgCl悬浊液中通HI:Ag++HI═AgI↓+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只闭合K2,该装置将电能转化为化学能 | |
| B. | 只闭合K1,石墨棒周围溶液pH逐渐升高 | |
| C. | 只闭合K2,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | 铁腐蚀的速度由大到小的顺序是:只闭合K1>都断开>只闭合K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com