
| A. | H2S+H2SO4(浓) | B. | Cu+H2SO4(浓) | C. | C+H2SO4 (浓) | D. | CuO+H2SO4 (浓) |
分析 硫酸在反应中表现为氧化性,应存在化合价的变化,S元素的化合价降低,又表现出酸性,应生成硫酸盐,据此解答.
解答 解:A.浓硫酸与硫化氢反应生成硫、二氧化硫和水,浓硫酸中硫元素化合价降低,只表现强的氧化性,故A不选;
B.浓硫酸与铜反应生成硫酸铜、二氧化硫和水,发生氧化还原反应,生成硫酸铜,表现出酸性,故B选;
C.浓硫酸与木炭粉反应,生成二氧化硫、二氧化碳和水,没有盐生成,浓硫酸只表现出氧化性,故C不选;
D.CuO和H2SO4(浓)反应生成CuSO4和水,硫元素化合价不变,只表现为酸性,故D不选;
故选:B.
点评 本题考查浓硫酸的性质,侧重于学生的分析能力和元素化合物知识的理解和运用的考查,为高频考点,注意浓硫酸的特性,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
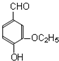 )是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
)是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
. )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、Ba(NO3)2、NaCl | B. | Ba(NO3)2、KCl、MgCl2 | ||
| C. | Na2CO3、BaCl2、MgCl2 | D. | Na2CO3、K2CO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com