
下列离子方程式正确的是( )
A.Ca(HCO3)2溶液中加入过量NaOH溶液Ca2++HCO3-+OH-= CaCO3↓ +H2O
B.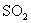 通入溴水中
通入溴水中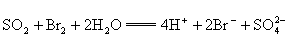
C.泡沫灭火器原理:2Al3+ +3CO32- +3H2O===2Al(OH)3↓ +3CO2↑
D.FeO与稀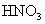 反应
反应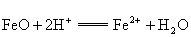
科目:高中化学 来源: 题型:
250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ•mol-1,自发进行的原因是 ( )
A. 是吸热反应 B. 是放热反应
C. 是熵减少的反应 D. 熵增大效应大于焓变效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中氯离子浓度与50mL 1 mol·L-1 AlCl3溶液中氯离子浓度相等的是 ( )
A.150ml 1mol·L-1 NaCl溶液 B.75ml 2mol·L-1 KClO3溶液
C.150ml 2mol·L-1 KCl溶液 D.75ml 1mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
 A、若
A、若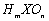 为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B、若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C、若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D、若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学反应的认识正确的是( )
A.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
B.如果某化学反应的ΔH和ΔS均小于0,则反应一定能自发进行
C.化学反应过程中,一定有化学键的断裂和形成
D.反应物的总焓大于生成物的总焓时,ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达平衡时,X的转化率为50%
B.反应可表示为:X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.KClO3 和SO3 溶于水后能导电,故KClO3 和SO3 为电解质
B.25℃时、用醋酸溶液滴定等浓度NaOH 溶液至pH=7,V 醋酸<V NaOH
C.向NaAlO2 溶液中滴加NaHCO3 溶液,有沉淀和气体生成
D.AgCl 易转化为AgI 沉淀且K(AgX)=c(Ag+ )·c(X—),故K(AgI)<K(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中
C(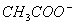 )>C(Na+),对该混合溶液的下列判断正确的是 ( )
)>C(Na+),对该混合溶液的下列判断正确的是 ( )
A.C(H+)>C(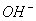 )
)
B.C(CH3COOH)+C(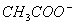 )=0.2 mol/L
)=0.2 mol/L
C.C(CH3COOH)>C(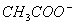 )
)
D.C(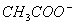 )+C(OH-)=0.2 mol/L
)+C(OH-)=0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)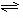 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)
(2)O2 (g)= O+2(g)+e-  H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6(g)+ e-1 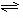 PtF6-(g)
PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6-  H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×12-11,KsP[Cu(OH)2]=2.2×12-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c( ),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________
),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com