
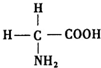
 氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体.
氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体. 分析 根据价层电子对互斥理论确定N原子的价层电子对数,再确定杂化类型;同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;根据价层电子对互斥理论确定N原子的价层电子对数,再确定杂化类型、分子空间构型.
解答 解:甘氨酸中N原子含有一个孤电子对和三个共价键,则N原子的价层电子对数为4,所以杂化类型为sp3;
C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C;
NH4+中N原子的价层电子对数为4+$\frac{1}{2}$(5-1-4×1)=4,而且没有孤电子对,所以离子的空间构型为正四面体;
故答案为:sp3;N>O>C;正四面体.
点评 本题考查了杂化类型的判断、第一电离能的比较、微粒空间构型的判断,注意把握价层电子对互斥理论的内容及应用,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为8NA | |
| C. | 0.44g C3H8中含有的共用电子对总数目为0.08NA | |
| D. | 常温常压下,100 mL 0.5 mol/L 的乙酸溶液中,乙酸的分子数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| B. | 在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32-、Cl-一定能够大量共存 | |
| C. | 氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+A12O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g CH4含有4NA个氢原子 | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移2NA个电子 | |
| C. | 1L0.1 mol•L-1(NH4)2SO4溶液中含有0.2NA个NH4+ | |
| D. | 10 L pH=l的硫酸溶液中含有的H+离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素中,最高价氧化物的水化物酸性:Z的最强 | |
| B. | 氢化物稳定性:Y的最强 | |
| C. | 原子半径由小到大顺序:Y<Z<M<X | |
| D. | 同周期元素中M元素原子失电子最多,其单质的还原性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| B. | 将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O→2C6H5OH+SO32- | |
| C. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O | |
| D. | 工业上可用电解法制备Mg:2MgO$\frac{\underline{\;熔融\;}}{电解}$2Mg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (A-x+m)mol | B. | (A-x-m)mol | C. | $\frac{W}{A}$(A-x+m)mol | D. | $\frac{W}{A}$(A-x-m)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com