
 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.分析 (1)铝热反应实质是铝粉和铁的氧化物发生氧化还原反应生成铁和氧化铝;
(2)铝和氢氧化钠溶液反应生成偏氯酸钠和氢气;
(3)铝土矿粉粹是增大固体与溶液接触面积,加快反应速率,氧化铝溶于氢氧化钠溶液反应生成偏氯酸钠,加入过量的试剂A使所得溶液中析出Al(OH)3固体,碳酸酸性大于氢氧化铝,说明是通入二氧化碳生成;电解熔融Al2O3时,氧化铝熔点高耗能高,加入冰晶石会降低反应物熔点分析;
(4)设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;铝元素的存在形式为:AlO2-;
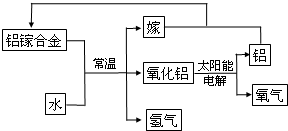
(5)i、依据转化关系图中物质分析判断,铝镓合金和水反应生成氧化铝、镓和氢气;
ii、A.工艺流程中,太阳能转化为电能、电能转化为化学能、化学能转变为热能;
B.前边操作中用的物质,在后续操作中又得到该物质,则该物质就可循环使用;
C、合金熔点低于各成分;
D、根据反应物与最终产物,据此整个过程实质是水分解生成氢气与氧气,该工艺中总反应为:2H2O=H2↑+O2↑.
解答 解:(1)铝粉和铁的氧化物(FeO•Fe2O3)可配成铝热剂用于焊接钢轨,铝粉和铁的氧化物发生氧化还原反应生成铁和氧化铝,反应的化学方程式为8Al+3FeO•Fe2O$\frac{\underline{\;\;△\;\;}}{\;}$4Al2O3+9Fe,
故答案为:8Al+3FeO•Fe2O$\frac{\underline{\;\;△\;\;}}{\;}$4Al2O3+9Fe;
(2)NaOH溶液可以除去铝表面的氧化膜,在处理过程中常会产生H2,铝和氢氧化钠溶液反应生成偏氯酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)铝土矿粉粹是增大固体与溶液接触面积,加快反应速率,氧化铝溶于氢氧化钠溶液反应生成偏氯酸钠,加入过量的试剂A使所得溶液中析出Al(OH)3固体,碳酸酸性大于氢氧化铝,说明是通入二氧化碳生成;电解熔融Al2O3时,氧化铝熔点高耗能高,加入冰晶石会降低反应物熔点,节约能源,
故答案为:增大接触面积,加快反应速率;CO2;降低反应混合物熔点,节约能源;
(4)设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;
铝元素的存在形式为:AlO2-.
故答案为:AlO2-;
(5)i、依据转化关系图中物质分析判断,铝镓合金和水反应生成氧化铝、镓和氢气,反应的化学方程式为:2AlGa+3H2O=Al2O3+2Ga+3H2↑,
故答案为:2AlGa+3H2O=Al2O3+2Ga+3H2↑;
ii、A.工艺流程中,太阳能转化为电能、电能转化为化学能、化学能转变为热能,该过程中,能量的转化形式不只有两种,故A错误;
B.前边操作中用的物质,在后续操作中又得到该物质,则该物质就可循环使用,转化关系中铝镓合金反应最后生成可以循环使用,故B正确;
C、合金熔点低于各成分,铝镓合金的熔点比金属铝低,故C正确;
D、根据反应物与最终产物,据此整个过程实质是水分解生成氢气与氧气,该工艺中总反应为:2H2O=H2↑+O2↑D正确,该工艺可利用太阳能分解水,故D正确,故选BCD.
故答案为:2AlGa+3H2O=Al2O3+2Ga+3H2↑;BCD.
点评 本题多角度考查元素化合物知识,为高频考点,侧重于学生的分析、实验能力,题目涉及镁铝性质的分析判断,物质反应产物判断,流程分析应用,注意相关基础知识的积累,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | Zn2++2e-═Zn | B. | Cu2++2e-═Cu | C. | Zn-2e-═Zn2+ | D. | 2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物理性质 | 熔点 | 沸点 | 溶解性 |
| SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com