
稀氨水中存在下述电离平衡:NH3+H2O⇌NH3•H2O⇌NH4++OH﹣加入下列物质:请在答题卡上相应空格处填上:正向移动、逆向移动或不移动.
| 加入的物质 | NH4Cl | NH3 | NaOH |
| 平衡移动的方向 | (1) | (2) | (3) |
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
Na2CO3俗名纯碱,下列对Na2CO3采用不同分类法的分类.不正确的是( )
|
| A. | Na2CO3是碱 | B. | Na2CO3是盐 | C. | Na2CO3是正盐 | D. | Na2CO3是钠盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
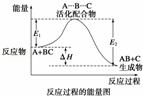
|
| A. | 反应过程可表示为 |
|
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 |
|
| C. | 正反应的热效应为△H=E1﹣E2<0,所以正反应为放热反应 |
|
| D. | 此图中逆反应的热效应△H=E1﹣E2<0,所以逆反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能大量共存的是( )
|
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣ |
|
| B. | 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣ |
|
| C. | 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣ |
|
| D. | 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用不正确的是( )
|
| A. | 原子核内有18个中子的氯原子: |
|
| B. | S2﹣的结构示意图: |
|
| C. | 钒原子电子排布式:[Ar]3d34s2 |
|
| D. | NH4Br的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
I.下列实验操作或对实验事实的描述中,正确的是________(填序号)。
①用量筒量取稀硫酸溶液8.0 mL;
②Fe(OH)3胶体与FeCl3溶液的混合物可用过滤的方法分离;
③用湿润的pH试纸测量某溶液pH时,测量值可能比真实值小;
④用碱式滴定管量取KMnO4溶液20.50 mL;
⑤在实验室中用锌和稀硫酸反应制氢气,为加快反应速率而不影响H2的品质,可向溶液中加适量Cu(NO3)2晶体。
Ⅱ.将某98%的浓硫酸样品敞口露置于空气中,放置24 h后,取出5 mL浓硫酸与18 mL 9 mol·L-1的NaOH溶液恰好完全中和。请回答下列问题:
(1)该硫酸样品露置24 h后,其物质的量浓度是___________mol·L-1。
(2)若分别用下列方法鉴别浓硫酸和稀硫酸,可以达到目的的是____________(填序号)。
a.常温下加入铜片 b.常温下加入铁片
c.常温下加入木炭 d.用玻璃棒各蘸取少许涂在滤纸上
(3)工业上利用过量氨水吸收硫酸工业尾气中的有害物质,请写出该过程中发生的一个反应的离子方程式_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com