
ЁОЬтФПЁПЯТСагаЙиЪЕбщдРэЁЂЗНЗЈКЭНсТлЖМе§ШЗЕФЪЧЃЈ ЃЉ
A.ЯђБЅКЭFeCl3ШмвКжаЕЮМгЙ§СПАБЫЎЃЌПЩжЦШЁFeЃЈOHЃЉ3НКЬх
B.ШЁЩйСПШмвКXЃЌЯђЦфжаМгШыЪЪСПаТжЦТШЫЎЃЌдйМгМИЕЮKSCNШмвКЃЌШмвКБфКьЃЌЫЕУїXШмвКжавЛЖЈКЌгаFe2+
C.ЯђФГЮоЩЋШмвКжаМгШыЯЁбЮЫсЮоЯжЯѓЃЌдйМгШыBaCl2ШмвКВњЩњАзЩЋГСЕэЃЌжЄУїКЌSO42ЁЅ
D.вбжЊI3Љ![]() I2+IЉ ЃЌ ЯђЪЂгаKI3ШмвКЕФЪдЙмжаМгШыЪЪСПCCl4 ЃЌ еёЕДОВжУКѓCCl4ВуЯдзЯЩЋЃЌЫЕУїKI3дкCCl4жаЕФШмНтЖШБШдкЫЎжаЕФДѓ
I2+IЉ ЃЌ ЯђЪЂгаKI3ШмвКЕФЪдЙмжаМгШыЪЪСПCCl4 ЃЌ еёЕДОВжУКѓCCl4ВуЯдзЯЩЋЃЌЫЕУїKI3дкCCl4жаЕФШмНтЖШБШдкЫЎжаЕФДѓ
ЁОД№АИЁПC
ЁОНтЮіЁП
AЃЎЯђБЅКЭFeCl3ШмвКжаЕЮМгЙ§СПАБЫЎЕУЕНЕФЪЧFe(OH)3ГСЕэЃЌВЛЪЧНКЬхЃЌAЯюВЛЗћКЯЬтвтЃЛ
BЃЎгЩгкУЛгаЯШМгKSCNШмвКЖјжБНгМгСЫТШЫЎЃЌЫљвдВЛФмШЗЖЈдШмвКЪЧгаFe2+ЛЙЪЧFe3+ ЃЌ BЯюВЛЗћКЯЬтвтЃЛ
CЃЎШєШмвКжаКЌгаAgЃЋ ЃЌ дђМгШыBaCl2ШмвКЃЌвВЛсВњЩњАзЩЋГСЕэЃЌCЯђФГЮоЩЋШмвКжаМгШыЯЁбЮЫсЮоЯжЯѓЃЌдйМгШыBaCl2ШмвКВњЩњАзЩЋГСЕэЃЌжЄУїКЌSO42ЁЅЃЌCЯюЗћКЯЬтвтЃЛ
DЃЎЪЙCCl4ВуЯдзЯЩЋЕФЪЧI2 ЃЌ ЖјВЛЪЧI3- ЃЌ ЫљвдЫЕУїI2дкCCl4ВужаЕФШмНтЖШДѓЃЌDЯюВЛЗћКЯЬтвтЃЛ
Д№АИбЁCЁЃ
AЃЎЕУЕНЕФЪЧFe(OH)3ГСЕэЃЌВЛЪЧНКЬх
BЃЎТШЫЎОпЧПбѕЛЏадЛсНЋFe2+бѕЛЏГЩFe3+ ЃЌ ашЯШМгKSCNЮоЯжЯѓЃЈFe3+ЃЉЃЌдйЕЮМгТШЫЎБфКьЃЈгаFe2+зЊЛЏЮЊFe3+ЃЉ
CЃЎМгШыBaCl2ШмвКЃЌгаВЛЭЌГСЕэЃЈСђЫсБЕЁЂТШЛЏвјЁЂЬМЫсБЕЕШЃЉЃЌЫљвдЯШМгHClЮоЯжЯѓПЩХХГ§ЦфЫћРызгИЩШХЃЌдйМгBaCl2ШмвКМьбщSO42ЁЅ
DЃЎЪЙCCl4ВуЯдзЯЩЋЕФЪЧI2 ЃЌ гыKI3ЮоЙиЁЃжЛФмЫЕУїI2взШмгкгаЛњШмМС


 аТПЮБъЭЌВНбЕСЗЯЕСаД№АИ
аТПЮБъЭЌВНбЕСЗЯЕСаД№АИ вЛЯпУћЪІПкЫугІгУЬтЬьЬьСЗвЛБОШЋЯЕСаД№АИ
вЛЯпУћЪІПкЫугІгУЬтЬьЬьСЗвЛБОШЋЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЦЋЖўМзыТ(C2H8N2)ЪЧвЛжжИпФмШМСЯЃЌШМЩеВњЩњОоДѓФмСПЃЌПЩзїЮЊКНЬьдЫдиЛ№М§ЕФЭЦЖЏСІЁЃЯТСаа№Ъіжае§ШЗЕФЪЧ(ЁЁ ЁЁ)
A. ЦЋЖўМзыТШМЩеЪЧбѕЛЏЛЙдЗДгІ
B. 6.02ЁС1023ИіЦЋЖўМзыТЗжзгжаCЕФЮяжЪЕФСПЮЊ1mol
C. 1 molЦЋЖўМзыТжаКЌгаNAИіN2
D. ЦЋЖўМзыТШМЩеЮќЪеШШСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаШчЯТгаЛњЮяЃКЃЈУППевЛЗжЃЉ
Ђй ![]() Ђк
Ђк ![]() Ђл
Ђл ![]() ЂмCH3CH=CHCH3 Ђн
ЂмCH3CH=CHCH3 Ђн ![]() Ђо
Ђо ![]() Ђп
Ђп ![]()

ЃЈ1ЃЉЛЅЮЊЭЌЗжвьЙЙЬхЕФЪЧЃК ЃЌ ДцдкЪжадвьЙЙЬхЕФЪЧЃК ЃЌ ДцдкЫГЗДвьЙЙЬхЕФЪЧ ЃЌ ЛЅЮЊЭЌЯЕЮяЕФЪЧЃЈШЮаДвЛЖдЃЉЃКЃЛ
ЃЈ2ЃЉЧтКЫДХЙВеёЃЈ1HЉNMRЃЉЭМЦзШчЩЯЭМЫљЪОЕФгаЃЛ
ЃЈ3ЃЉЩЯЪіЮяжЪжаЃЌВЛЪєгкЭЌЗжвьЙЙЬхЃЌЯрЭЌжЪСПЪБЃЌдкбѕЦјжаЭъШЋШМЩеЯћКФЕФбѕЦјЕФжЪСПЭъШЋЯрЭЌЕФЬўЪЧЃКЃЛ
ЃЈ4ЃЉгаЛњЮяЂмЕФЯЕЭГУќУћЗЈУћГЦЪЧЃЛ
ЃЈ5ЃЉгаЛњЮяЂнЕФМќЯпЪН ЃЌ ЦфЗжзгжаЬМдзгдгЛЏЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯрЭЌжЪСПЕФСНЗнТСЗжБ№ЗХШызуСПЕФбЮЫсКЭЧтбѕЛЏФЦШмвКжаГфЗжЗДгІЃЌЯћКФЕФТШЛЏЧтКЭЧтбѕЛЏФЦЕФЮяжЪЕФСПжЎБШЮЊ ЃЈ ЃЉ
A. 1ЃК1B. 1ЃК6C. 2ЃК3D. 3ЃК1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСааджЪЕФЕнБфЙцТЩВЛе§ШЗЕФЪЧ
A. NaOHЁЂKOHЁЂCsOHМюадвРДЮдіЧП
B. LiЁЂNaЁЂKЁЂRbЁЂCsЕФЪЇЕчзгФмСІж№НЅдіЧП
C. Al3+ЁЂMg2+ЁЂNa+ЕФРызгАыОЖвРДЮМѕаЁ
D. F2ЁЂCl2ЁЂBr2ЁЂI2ЕФШлЗаЕувРДЮЩ§ИпЁЂУмЖШвРДЮдіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгаН№ЪєЕЅжЪAЁЂBЁЂCКЭЦјЬхМзЁЂввЁЂБћвдМАЮяжЪDЁЂEЁЂFЁЂGЁЂHЃЌЫќУЧжЎМфЕФЯрЛЅзЊЛЏЙиЯЕШчЭМ1ЫљЪОЃЈЭМжагааЉЗДгІЕФЩњГЩЮяКЭЗДгІЕФЬѕМўУЛгаБъГіЃЉЃЎ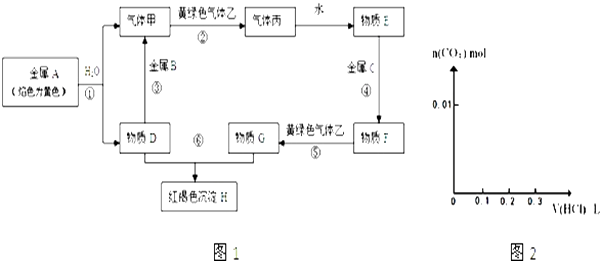
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉаДГіЯТСаЮяжЪЕФЛЏбЇЪНЃКBЁЂБћЁЂвв ЃЎ
ЃЈ2ЃЉаДГіЯТСаЗДгІЕФРызгЗНГЬЪНЃК
ЗДгІЂйЃЛ
ЗДгІЂнЃЛ
ЗДгІЂо ЃЎ
ЃЈ3ЃЉНЋ0.4g DКЭ1.06g Na2CO3ЛьКЯВЂХфГЩШмвКЃЌЯђШмвКжаЕЮМг0.1molLЉ1ЯЁбЮЫсЃЎдкШчЭМ2ЫљЪОЕФзјБъЯЕжаЛГіФме§ШЗБэЪОМгШыбЮЫсЕФЬхЛ§КЭЩњГЩCO2ЕФЮяжЪЕФСПЕФЙиЯЕЭМЯѓ ЃЎ
ЃЈ4ЃЉНЋ18.4 g D КЭNaHCO3ЙЬЬхЛьКЯЮяЃЌдкУмБеШнЦїжаМгШШЕНдМ250ЁцЃЌОГфЗжЗДгІКѓХХГіЦјЬхЃЌРфШДЃЌГЦЕУЪЃгрЙЬЬхжЪСПЮЊ16.6 gЁЃЪдМЦЫуЛьКЯЮяжаNaOHЕФжЪСПЗжЪ§ЁЃ(ЧыаДГіМЦЫуЙ§ГЬ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕЊЁЂЬМЖМЪЧживЊЕФЗЧН№ЪєдЊЫиЃЌКЌЕЊЁЂЬМдЊЫиЕФЮяжЪдкЙЄвЕЩњВњжагаживЊЕФгІгУЃЎ
ЃЈ1ЃЉЧыаДГіЙЄвЕЩЯгЩNH3жЦШЁNOЕФЛЏбЇЗНГЬЪН ЃЎ
ЃЈ2ЃЉвЛЖЈЬѕМўЯТЃЌЬњПЩвдКЭCO2ЗЂЩњЗДгІЃКFeЃЈsЃЉ+CO2ЃЈgЃЉFeOЃЈsЃЉ+COЃЈgЃЉЃЌвбжЊИУЗДгІЕФЦНКтГЃЪ§KгыЮТЖШTЕФЙиЯЕШчЭМЫљЪОЃЎ
ЂйИУЗДгІЕФФцЗДгІЪЧЃЈЬюЁАЮќШШЁБЛђЁАЗХШШЁБЃЉЗДгІЃЎ
ЂкTЁцЁЂP paбЙЧПЯТЃЌдкЬхЛ§ЮЊVLЕФШнЦїжаНјааЗДгІЃЌЯТСаФмЫЕУїЗДгІДяЕНЦНКтзДЬЌЕФЪЧ ЃЎ
AЁЂЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйБфЛЏЃЛ
BЁЂШнЦїФкбЙЧПВЛдйБфЛЏЃЛ
CЁЂvе§ЃЈCO2ЃЉ=vФцЃЈFeOЃЉ
ЂлT1ЮТЖШЯТЃЌЯђЬхЛ§ЮЊV LЕФУмБеШнЦїжаМгШызуСПЬњЗлВЂГфШывЛЖЈСПЕФCO2 ЃЌ ЗДгІЙ§ГЬжаCOКЭCO2ЮяжЪЕФСПгыЪБМфЕФЙиЯЕШчЭМввЫљЪОЃЎдђCO2ЕФЦНКтзЊЛЏТЪЮЊ ЃЌ ЦНКтЪБЛьКЯЦјЬхЕФУмЖШгыЦ№ЪМЪБЦјЬхЕФУмЖШжЎБШЮЊ ЃЎ
ЃЈ3ЃЉдкКуЮТЬѕМўЯТЃЌЦ№ЪМЪБШнЛ§ОљЮЊ5LЕФМзЁЂввСНУмБеШнЦїжаЃЈМзЮЊКуШнШнЦїЁЂввЮЊКубЙШнЦїЃЉЃЌОљНјааЗДгІЃКN2+3H22NH3 ЃЌ гаЙиЪ§ОнМАЦНКтзДЬЌЬиЖЈМћБэЃЎ
ШнЦї | Ц№ЪМЭЖШы | ДяЦНКтЪБ | |||
Мз | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | ЭЌжжЮяжЪЕФЬхЛ§ЗжЪ§ЯрЭЌ |
вв | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
Ц№ЪМЪБввШнЦїжаЕФбЙЧПЪЧМзШнЦїЕФБЖЃЎ
ЃЈ4ЃЉвЛЖЈЬѕМўЯТЃЌ2.24LЃЈелЫуЮЊБъзМзДПіЃЉN2OКЭCOЕФЛьКЯЦјЬхдкЕуШМЬѕМўЧЁКУЭъШЋЗДгІЃЌЗХГіbkJШШСПЃЎЩњГЩЕФ3жжВњЮяОљЮЊДѓЦјзщГЩЦјЬхЃЌВЂВтЕУЗДгІКѓЦјЬхЕФУмЖШЪЧЗДгІЧАЦјЬхУмЖШЕФ ![]() БЖЃЎЧыаДГіИУЗДгІЕФШШЛЏбЇЗНГЬЪН ЃЎ
БЖЃЎЧыаДГіИУЗДгІЕФШШЛЏбЇЗНГЬЪН ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкМюН№ЪєЕФЫЕЗЈВЛе§ШЗЕФЪЧ ЃЈ ЃЉ
A. дзгзюЭтВуЕчзгЪ§ЖМЪЧ1
B. ЕЅжЪЕФШлЕуЫцзХдзгађЪ§ЕФЕндіЖјдіДѓ
C. дзгАыОЖЫцзХдзгађЪ§ЕФЕндіЖјдіДѓ
D. ЕЅжЪгыбѕЦјЖМФмЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊAЁЂBЁЂCЁЂDЁЂEДњБэЮхжждЊЫиЁЃAдЊЫиЕФШ§МлРызг3dФмМЖДІгкАыГфТњЃЛBдЊЫидзгЕФзюЭтВуЕчзгЪ§ЪЧФкВуЕчзгзмЪ§ЕФ2БЖЃЛCЕФдзгЙьЕРжага2ИіЮДГЩЖдЕФЕчзгЃЌЧвгыBПЩаЮГЩСНжжГЃМћЕФЦјЬхЃЛDЕФдзгађЪ§аЁгкAЃЌDгыCПЩаЮГЩDC2КЭDC3СНжжЗжзгЃЌЧвDC2ЪЧМЋадЗжзгЃЌDC3ЪЧЗЧМЋадЗжзгЃЛEЪЧЖЬжмЦкдЊЫижаГ§СЫЯЁгаЦјЬхЭтдзгАыОЖзюДѓЕФдЊЫиЁЃЪдЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉаДГіAдЊЫиЛљЬЌдзгЕФЕчзгХХВМЪНЁЃ
ЃЈ2ЃЉBЁЂCЁЂDШ§жждЊЫиЕФЕчИКадгЩДѓЕНаЁЕФЫГађЮЊ(аДдЊЫиЗћКХ)ЁЃ
ЃЈ3ЃЉEгыCвд1:1аЮГЩЕФЮяжЪЕФЕчзгЪНЮЊЁЃ
ЃЈ4ЃЉгУVSEPRРэТлХаЖЯDC3ЗжзгЕФПеМфСЂЬхНсЙЙЮЊЁЃ
ЃЈ5ЃЉдЊЫижмЦкБэжаЕквЛЕчРыФмзюДѓЕФдЊЫиЪЧ(ЬюдЊЫиЗћКХ)ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com