
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是_________________(填分子式)。产生这种结果的主要原因是(用离子方程式表示)_________________。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行认真探究。
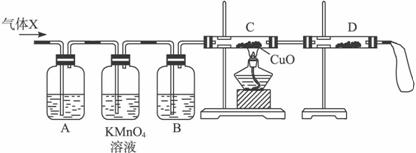
①组装好仪器后,盛放药品前,必要的一个操作是__________________________________。
②A中加入的试剂可能是____________,作用是__________________________________。
B中加入的试剂可能是____________,作用是____________________________________。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是____________________,D中最好选择的试剂是_________________。
(3)假定气体在吸收过程中吸收完全,对上述装置略加改进,可以粗略测定气体X中SO2的体积分数。改进时可选用的下列仪器为_________________(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
(1)H2 Zn+2H+====H2↑+Zn2+
(2)①检查装置的气密性
②NaOH溶液(其他合理答案也可) 除去SO2气体
浓硫酸 干燥氢气
③固体由黑色变成红色 无水硫酸铜
(3)a、c、e、g
解析:(1)98%的浓硫酸浓度减小至一定程度,溶液中H+亦能与Zn反应,Zn+2H+====Zn2++H2↑,导致所制SO2中混有H2。(2)①组装好仪器后,盛放药品前的必要操作是检验装置的气密性。②和③由C中盛CuO,可知利用反应H2+CuO![]() Cu+H2O的预期现象是否出现来确定是否含有H2,而D处固态试剂应用于确认产物H2O,则D处固态试剂为无水硫酸铜。为防止干扰,检验H2前应除去SO2并干燥,据此可知A处应盛能吸收SO2的试剂,如NaOH溶液、FeCl3溶液、品红等,而B处应盛浓H2SO4。(3)混合气体中SO2的多少可通过称量A、B的质量变化算出,而H2的多少可通过排水量气法得出,故需选用a、c、e、g以组成量气装置。
Cu+H2O的预期现象是否出现来确定是否含有H2,而D处固态试剂应用于确认产物H2O,则D处固态试剂为无水硫酸铜。为防止干扰,检验H2前应除去SO2并干燥,据此可知A处应盛能吸收SO2的试剂,如NaOH溶液、FeCl3溶液、品红等,而B处应盛浓H2SO4。(3)混合气体中SO2的多少可通过称量A、B的质量变化算出,而H2的多少可通过排水量气法得出,故需选用a、c、e、g以组成量气装置。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
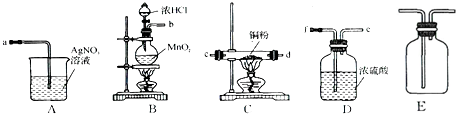
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是__________(填分子式)。产生这种结果的主要原因足(用离子方程式表示) ______________________。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学没计了如下实验,对气体X取样进行认真探究。
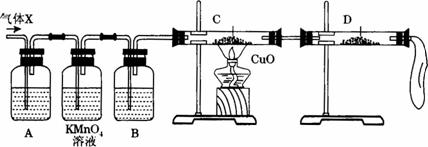
①组装好仪器后,盛放药品前,必要的一个操作是___________________________________。
②A中加入的试剂可能是__________________,作用是____________________________。
B中加入的试剂可能是____________________,作用是____________________________。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是______________,D中最好选择的试剂是______________________。
(3)假定气体在吸收过程中吸收完全,对上述装置略加改进,可以粗略测定气体X中SO2的体积分数。改进时可选用的下列仪器为__________________(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组需制备22.4 LSO2气体(标准状况),他们依据化学方程式Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。
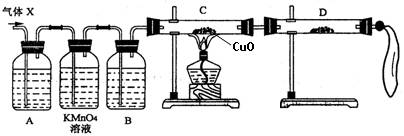
①组装好仪器后,盛放药品前,必要的一个操作是 。
②A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 ,作用是 。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是 ,D中最好选择的试剂是 。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为 (填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com