
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯(C4H6)分别在空气中充分燃烧,所耗用氧气的量依次增大 | |
| C. |  的单体是Cl-CH=CH2 的单体是Cl-CH=CH2 | |
| D. | 用新制氢氧化铜悬浊液不能鉴别乙醇溶液和葡萄糖溶液 |
分析 A.葡萄糖为单糖,不能水解;
B.等质量的甲烷、乙烯、1,3-丁二烯(C4H6),含H的质量越多,消耗氧气越多;
C.主链中均为碳碳单键,则单体含碳碳双键;
D.葡萄糖含-CHO,可与氢氧化铜悬浊液反应,而乙醇不能.
解答 解:A.葡萄糖为单糖,不能水解,而蔗糖、油脂和蛋白质在一定条件下都能水解,故A错误;
B.等质量的甲烷、乙烯、1,3-丁二烯(C4H6),含H的质量越多,消耗氧气越多,由最简式CH4、CH2、CH1.5,可知所耗用氧气的量依次减少,故B错误;
C.主链中均为碳碳单键,则单体含碳碳双键,则单体是Cl-CH=CH2,故C正确;
D.葡萄糖含-CHO,可与氢氧化铜悬浊液反应,而乙醇不能,则用新制氢氧化铜悬浊液能鉴别乙醇溶液和葡萄糖溶液,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5Na | |||||||||||
| B. | 用惰性电极电解足量氯化钠溶液,当阴极生成气体质量为2g时,溶液中转移电子数为2Na | |||||||||||
| C. | 一定温度下,若用Kw表示水的离子积,Kb表示一水合氨的电离常数,则该温度下水解平衡常数K=$\frac{{K}_{W}}{{K}_{b}}$ | |||||||||||
| D. | 已知如表所示数据:
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
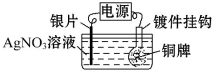
| A. | 通电后,Ag+向阳极移动 | |
| B. | 银片与电源负极相连 | |
| C. | 该电解池的阴极反应可表示为Ag++e-═Ag | |
| D. | 当电镀一段时间后,将电源反接,铜牌可恢复如初 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
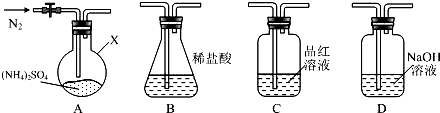
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
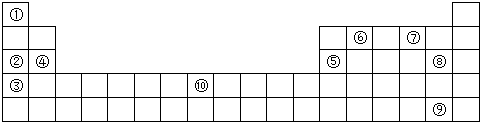
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ①③④⑦ | D. | ①③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
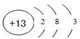 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液pH不断增大,最后为7 | B. | 阳极先析出Cl2,后析出O2 | ||
| C. | 阴极始终只析出H2 | D. | 电解最后阶段为电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
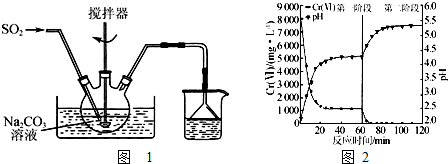
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com