
| A. | 1molC5H12O中含有的共价键数目为17NA | |
| B. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3.5NA | |
| C. | 在铁和氯气的反应中,1mol铁失去的电子数为2NA | |
| D. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA |
分析 A、C5H12O含17条共价键;
B、Na2O和Na2O2均由2个钠离子和1个阴离子构成;
C、氯气和铁反应后变为+3价;
D、HCl溶于水后完全电离为氢离子和氯离子.
解答 解:A、C5H12O中含17条共价键,故1mol中含17NA条共价键,故A正确;
B、Na2O和Na2O2均由2个钠离子和1个阴离子构成,故1molNa2O和Na2O2混合物中含有的阴、阳离子为3mol,即3NA个,故B错误;
C、氯气和铁反应后变为+3价,故1mol铁失去3NA个电子,故C错误;
D、HCl溶于水后完全电离为氢离子和氯离子,故盐酸溶液中无HCl分子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 原子晶体中,共价键的键长越短,键能越大,熔点就越高 | |
| C. | 分子晶体中,共价键键能越大,该分子的熔沸点就越高 | |
| D. | 分子晶体中,分子间作用力越大,则分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铯的密度比钠大,熔点比钠高 | |
| B. | 氢氧化铯易溶于水 | |
| C. | 铯能与热水反应放出氢气,但与冷水不反应 | |
| D. | 铯与氯形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14组 | B. | 20组 | C. | 26组 | D. | 32组 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

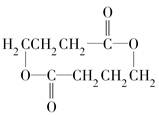 ;
;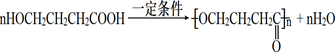 或
或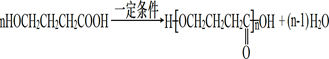 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为液态氨气化时吸热,可用液态氨作制冷剂 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com