
 实验测得不同温度下的平衡数据列于下表:
实验测得不同温度下的平衡数据列于下表:
| A.2v(NH3)=v(C02) | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
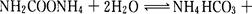
 该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:单选题
| A.2010年上海世博会中国馆外墙使用的太阳能电池可将太阳能转化为电能 |
| B.合成氨工业中使用高效催化剂可以加快反应速率,但不能提高平衡转化率 |
| C.寻找一种催化剂能在常温下将水分解成氢气和氧气并释放能量 |
| D.笔记本电脑、手机等中使用的锂离子电池属于二次电池 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+C(g),若A的浓度由0.1 mol·L
2B(g)+C(g),若A的浓度由0.1 mol·L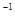 降到0.06 mol·L
降到0.06 mol·L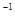 需20 s,那么由0.06 mol·L
需20 s,那么由0.06 mol·L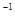 降到0.024 mol·L
降到0.024 mol·L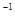 需要的时间
需要的时间查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+3H2(g) ΔH>0测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
CO(g)+3H2(g) ΔH>0测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
| A.10 min时,改变的外界条件可能是温度 |
| B.0~5 min内,V(H2)=0.1 mol·L-·min— |
| C.恒温下,缩小容器体积,平衡后c(H2)肯定减小 |
| D.10—12 min时反应的平衡常数逐渐增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是| A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1 |
| B.达平衡时压强变为原来的7/6 |
| C.此温度下该反应的平衡常数为0.005 |
| D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。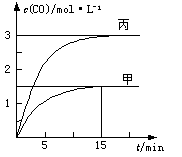
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
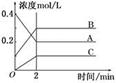
 2B(g)+C(g)
2B(g)+C(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com