
���� ��1��ԭ��ع���ԭ���ǣ�����ʧ���ӣ�����������Ӧ�������õ��ӣ�������ԭ��Ӧ�����ݵ��ԭ�����ش�
��2��������Ӧǰ�������з�Ӧ��2NH4++2e-=2NH3+H2��2MnO2+H2=Mn2O3+H2O�������IJ����Ǹ�����ʯī�������ӵ�����裬�ݴ˻ش�
��� �⣺��1��п�̸ɵ�طŵ�ʱ�ܷ�Ӧʽ�ɱ�ʾΪ��Zn+2MnO2+2NH4+�TZn2++Mn2O3��S��+2NH3+H2O��Znʧ���������������ĵ缫��ӦΪ��Zn-2e-=Zn2+����������ΪMnO2��������ԭ��Ӧ���缫��ӦʽΪ2MnO2+2NH4++2e-�TMn2O3+2NH3+H2O�����ݵ�ط�Ӧ��Zn+2MnO2+2NH4+�TZn2++Mn2O3+2NH3+H2O����طŵ��������ˮ������пͲ�䱡��ɸɵ�ر�����
�ʴ�Ϊ��2MnO2+2NH4++2e-�TMn2O3+2NH3+H2O��Zn-2e-=Zn2+����طŵ��������ˮ������пͲ�䱡��ɸɵ�ر�����
��2�������Ϸ�����Ӧ��2NH4++2e-=2NH3+H2��2MnO2+H2=Mn2O3+H2O��������Ӧ���м����H2������ʯī�����ӵ�����裬�������û��MnO2���룬�ɵ�ؽ����ڳ����ȶ�������
�ʴ�Ϊ��������Ӧ���м����H2������ʯī�����ӵ�����裮
���� ���⿼��ԭ��ص���ɺ���ԭ����Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬��Ŀ�ѶȲ�����ע��缫����ɺ͵缫��Ӧʽ�Լ��ܷ�Ӧʽ����д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��ϵ�һ���¿���ѧ���������棩 ���ͣ�ѡ����
���ݻ��̶���4L�ܱ������н��п��淴Ӧ��X(g)+2Y(g) 2Z(g)�����ﵽƽ�⡣�ڴ˹����У���Y��Ũ�ȸı��ʾ�ķ�Ӧ����v(��)��v(��)��ʱ��t��ϵ��ͼ����ͼ����Ӱ���ֵ�����ɱ�ʾ (
2Z(g)�����ﵽƽ�⡣�ڴ˹����У���Y��Ũ�ȸı��ʾ�ķ�Ӧ����v(��)��v(��)��ʱ��t��ϵ��ͼ����ͼ����Ӱ���ֵ�����ɱ�ʾ (  )
)
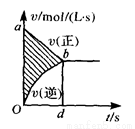
A ��X��Ũ�ȵļ��� B��Y���ʵ����ļ���
��X��Ũ�ȵļ��� B��Y���ʵ����ļ���
C. Z��Ũ�ȵ����� D��X���ʵ����ļ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Al2O3�� | B�� | ������������FeO�� | ||
| C�� | ���죨Fe2O3�� | D�� | ����[KAl��SO4��2•12H2O] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ʵ�����KHC2O4��H2C2O4����ˮ�����Һ��2c��K+���Tc��HC2O4-��+c��H2C2O4�� | |
| B�� | 0.1 mol•L-1NH4Cl��Һ��0.1 mol•L-1��ˮ�������ϣ�pH��7����c��NH3•H2O����c��NH${\;}_{4}^{+}$����c��Cl-����c��OH-�� | |
| C�� | 0.1mol/L��CH3COOH��Һ��ˮϡ�ͣ�$\frac{c��{H}^{+}��}{c��C{H}_{3}CO{O}^{-}��}$�ı�ֵ������ | |
| D�� | 0.1mol/LCH3COONa��Һ��0.15mol/LHCl�������ϣ�c��Cl-����c��H+����c��Na+����c��CH3COO-����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �٢� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4.4 g | B�� | 2.2 g | C�� | 5.5 g | D�� | 8.2 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʱ�䣨h�� ���ʵ�����mol�� | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com