
在一定温度下,向一固定容积的密闭容器中加入 1mol A和 2mol B,发生下述反应:A(g)+2B(g) 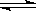 3C(g)+2D(s) △H>0。达到平衡时生成
3C(g)+2D(s) △H>0。达到平衡时生成 了1.8 mol C。
了1.8 mol C。
(1)在相同条件下,若向该容器中改为加入0.3mol A、0.6 mol B,要使平衡混合气体中C物质的体积分数与原平衡的相同,在D足量时,则还应加入 mol的物质C。
(2)若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.8 mol 。则D的起始物质的量n(D)应满足的条件是:n(D)___________。
当改变温度或压强时,有可能改变物质的聚集状态,对平衡产生影响。回答(3)(4)
(3)若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是:_________________;
(4)若将容器改为容积可变的容器,在一定温度和常压下,建立上述平衡之后,A的物质的量浓度为a mol/L。现持续增大压强,当:
①当压强为原来1.5倍时,A的平衡时物质的量浓度为m mol/L,测得m=1.5a;
②当压强为原来10倍时,A的平衡时物质的量浓度为n mol/L,测得n >10 a;
③当压强为原来100倍时,A的平衡时物质的量浓度为p mol/L,测得p<100a。
试解释形成这种结果的可能的原因:
①1.5倍时: ;
②10倍时: ;
③100倍时:  。
。
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 符合通式:CnH2n-2的有机物一定是炔烃 | |
| B. | 乙炔分子中碳碳叁键的键能不是碳碳单键和碳碳双键的键能之和 | |
| C. | 等质量的烃中含氢量越高,充分燃烧时,消耗的氧气越多 | |
| D. | 1-丁炔分子中的四个碳原子在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是
A.柠檬酸的电离会抑制碳酸的电离
B.该碳酸饮料中水 的电离受到抑制
的电离受到抑制
C.常温下,该碳酸饮料中KW的值大于纯水中KW的值
D.打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g).下列说法正确的是( )
Na2S(s)+4H2O(g).下列说法正确的是( )
A.该反应的平衡常数表达式K=c(H2O)/c(H2)
B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态
C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变
D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com