
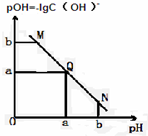
 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的变化关系如图所示,则正确的是( )
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的变化关系如图所示,则正确的是( )| A、M点所示溶液导电能力强于Q点 |
| B、N点所示溶液中c(Na+)>c(CH3COO-) |
| C、M点和N点所示溶液中水的电离程度相同 |
| D、Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |


科目:高中化学 来源: 题型:
| A、甲苯能使酸性KMnO4溶液褪色而苯不能 |
| B、乙二酸能使酸性KMnO4溶液褪色而乙酸不能 |
| C、纤维素在稀H2SO4催化下易水解而淀粉比较困难 |
| D、甲酸甲酯能够发生银镜反应而乙酸乙酯不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 实验现象 | 结论 | |
| A | 将湿润的蓝色石蕊试纸放在集气瓶口 | 试纸变红 | 该气体一定是SO2 |
| B | 加入稀盐酸,将产生的气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中可能含有CO32- |
| C | 通入少量氯气,再加几滴KSCN溶液 | 溶液变红 | 原溶液中一定含有Fe2+ |
| D | 加入BaCl2溶液,再加入稀盐酸 | 有白色沉淀生成 | 原溶液中一定含有SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、压强降低,反应减慢 |
| B、温度降低,反应加快 |
| C、使CO2浓度增加,反应加快 |
| D、使O2浓度增加,反应加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大 |
| B、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
| C、BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 |
| D、为准确测定盐酸与氢氧化钠溶液反应的中和热,所用酸和碱的物质的量应相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
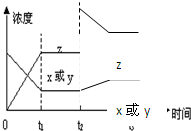 反应x(g)+y(g)?2z(g)△H<0,若反应开始经t1秒后达到平衡,t2秒后由于反应条件的改变使平衡破坏,t3时又达平衡(如图所示),试分析,从t2到t3曲线变化的原因是,t2时刻 ( )
反应x(g)+y(g)?2z(g)△H<0,若反应开始经t1秒后达到平衡,t2秒后由于反应条件的改变使平衡破坏,t3时又达平衡(如图所示),试分析,从t2到t3曲线变化的原因是,t2时刻 ( )| A、减小了x或y的浓度 |
| B、增大了Z的浓度 |
| C、增加了反应体系的压强 |
| D、升高了反应的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨基酸的晶体主要以内盐形式存在,调节溶液的pH可改变它在水中的溶解度 |
B、2013年4月,国家药监局批准抗H7N9流感的新药帕拉米韦 (结构如图)上市,该药品能与银氨溶液发生银镜反应. (结构如图)上市,该药品能与银氨溶液发生银镜反应. |
C、比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
| D、血红蛋白、牛胰岛素、蚕丝、过氧化氢酶、人造奶油充分水解均可得到氨基酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com