
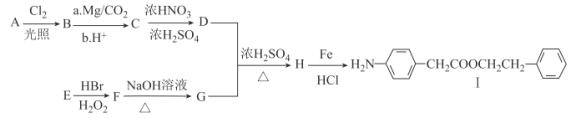
【题目】Ⅰ.是一种重要的有机合成中间体,由芳香烃A和E为有机原料和其他必要试剂制备Ⅰ的合成路线如图:
已知:Ⅰ.RX![]() RCOOH;
RCOOH;
Ⅱ.R—CH=CH2![]() R—CH2CH2Br;
R—CH2CH2Br;
Ⅲ.![]() 。
。
请回答下列问题:
(1)A的分子式为___。Ⅰ中含有官能团的名称为_____。
(2)C→D、H→I的反应类型分别为____、____。
(3)E的化学名称为______,一定条件下,E发生加聚反应的化学方程式为____。
(4)F→G的化学方程式为____。
(5)H的结构简式为____。
(6)同时满足下列条件的C的同分异构体有__种(不考虑立体异构);其中核磁共振氢谱有5组峰的结构简式为____。
①能与FeCl3溶液发生显色反应
②能发生银镜反应
【答案】C7H8 氨基、酯基 取代反应(或硝化反应) 还原反应 苯乙烯 ![]()
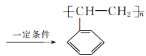
![]() +NaOH
+NaOH![]() +NaBr
+NaBr ![]() 13
13 ![]()
【解析】
由I的结构简式和题给信息逆推可知:A为![]() ,B为
,B为![]() ,C为
,C为![]() ,D为
,D为![]() ,E为
,E为![]() ,F为
,F为![]() ,G为
,G为![]() ,H
,H![]() 。
。
(1)A为甲苯,分子式为C7H8。I中含有的官能团为氨基和酯基。
(2)C→D为苯环上的硝化反应(取代反应),H→I是硝基转化为氨基的还原反应。
(3)E为苯乙烯,其发生加聚反应的化学方程式为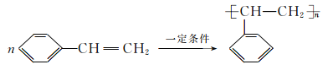 。
。
(4)F→G为卤代烃的水解反应,化学方程式为![]() +NaOH
+NaOH![]() +NaBr。
+NaBr。
(5)H的结构简式为![]() 。
。
(6)C的结构简式为![]() ,能与FeCl3溶液发生显色反应,说明含有酚羟基,能发生银镜反应,说明含有醛基。若苯环上有两个取代基:—CH2CHO和—OH,有3种同分异构体;若苯环上有三个取代基:—CHO、—CH3、—OH,有10种同分异构体,共13种。其中核磁共振氢谱有5组峰的结构简式为
,能与FeCl3溶液发生显色反应,说明含有酚羟基,能发生银镜反应,说明含有醛基。若苯环上有两个取代基:—CH2CHO和—OH,有3种同分异构体;若苯环上有三个取代基:—CHO、—CH3、—OH,有10种同分异构体,共13种。其中核磁共振氢谱有5组峰的结构简式为![]() 。
。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】2017年我国科学家研发了一种可充电镁一溴电池,其工作原理如图所示,电池的中间是只允许镁离子通过的离子选择性膜。电池的总反应为Mg+NaBr3===NaBr+MgBr2。下列说法错误的是( )

A. 放电过程中Mg2+通过离子选择性膜从负极区移向正极区
B. 放电时,正极反应式为Br3-+2e-=3Br-
C. 负极区电解液若改为镁盐的水溶液,则会发生副反应:Mg+2H2O===Mg(OH)2+H2↑
D. 充电过程中当0.1molMg2+通过离子选择性膜时,外电路导线中通过0.1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种微生物燃枓电池如图所示,下列关于该电池说法正确的是:

A. a电极为正极
B. H+由右室通过质子交换膜进入左室
C. a电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
D. 当b电极上产生lmolN2时,溶液中将有l0mole-通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。
请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)![]() C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
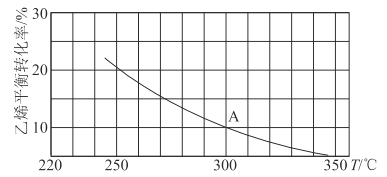
①该反应为____热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率__10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。

请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 ![]() 和
和![]() 是钍的两种同位素,
是钍的两种同位素,![]() 可以转化成
可以转化成![]() 。下列有关 Th 的说法正确的是( )
。下列有关 Th 的说法正确的是( )
①Th 元素的质量数是 232 ②![]() 和
和![]() 的化学性质相同 ③
的化学性质相同 ③![]() 转换成
转换成![]() 是化学变化 ④Th 元素的相对原子质量是 231 ⑤
是化学变化 ④Th 元素的相对原子质量是 231 ⑤![]() 和
和 ![]() 具有相同的最外层电子数
具有相同的最外层电子数
A.①②B.③④C.②⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A 是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2 ![]() 2CH3COOH。F 是高分子化合物。现以 A 为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。F 是高分子化合物。现以 A 为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
(1)A 的电子式为______,结构简式为_______。
(2)B、D 分子中的官能团名称分别是_______、_______。
(3)反应①~⑤的反应属于取代反应的是:_____。
(4)写出下列反应的化学方程式:①_____、④______、⑤_______。
(5)下列物质中,可以通过 A 加成反应得到的是_____(填序号)。
A.CH3CH3
B.CH3CHCl2
C.CH3CH2OH
D.CH3CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:

已知:
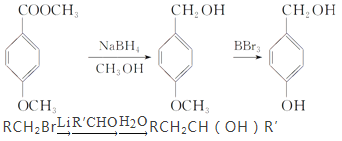
根据以上信息回答下列问题:
(1)白藜芦醇的分子式是________。
(2)C→D的反应类型是_________;E→F的反应类型是________。
(3)化合物A不与FeCL3溶液发生显色反应,能与NaHCO3反应放出CO2,推测其核磁共振氢谱(1H-NMR)中显示有_______种不同化学环境的氢原子,其个数比为_______。
(4)写出A![]() B反应的化学方程式_______
B反应的化学方程式_______
(5)写出化合物D、E的结构简式:D_______,E_______。
(6)化合物![]() 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:______。
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:______。
①能发生银镜反应;②含苯环县苯环上只有两种不同化学环境的氢原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com