
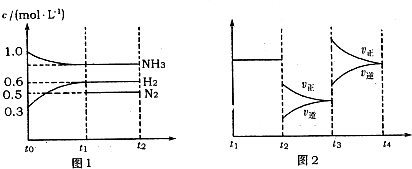
���� ��1���ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ٷֺ������䣬�Լ��ɴ�����������һЩ�����䣬�ݴ˷�����
��2����ͼ��֪��t0-t1��H2Ũ�ȱ仯��Ϊ0.6mol/L-0.3mol/L=0.3mol/L������v=$\frac{��c}{��t}$����v��H2����
��3����ͼ��֪��t3ʱ��˲�����������ʶ�����������Ӧ����������࣬ƽ��������Ӧ�����ƶ�������¶ȡ�ѹǿ��ƽ���Ӱ�������
��4����ͼ1��֪��ƽ��ʱ������������Ũ�ȣ����㰱����ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻
�����ʱ��Ũ���̣���ƽ�ⳣ���Ƚϣ��жϷ�Ӧ���з���
��5������Һ������Ũ�ȹ�ϵ����c��NH4+����c��Cl-��ʱ���ɵ���غ��֪c��H+����c��OH-������Һ�������ԣ����ѡ����ݷ�Ӧ�����Ĺ�ϵ���ж���Һ����ԣ�
�ڸ��ݵ���غ��ж���Һ��������������������Ũ�ȵ���Դ�С�������ж���Һ������ԣ�
��Һ�д���ƽ��NH3��H2O?NH4++OH-��������Һ��pHֵ������Һ��c��OH-��������������Ũ�ȼ���c��NH4+�������������غ������Һ��c��NH3��H2O��������NH3•H2O�ĵ��볣������ʽ����
��� �⣺��1��������ӦΪ2NH3��g��?N2��g��+3H2��g����H��0��
A���淴Ӧ����������ѹǿ����������ѹǿ���ٷ����仯��˵������ƽ�⣬��A��ȷ��
B��ƽ��ʱ����ֵĺ������䣬N2������������ٷ����仯��˵������ƽ�⣬��B��ȷ��
C����������������ʼ�ղ������仯����C����
D�������ڻ����������������䣬�������ݻ����䣬�����������ܶ�ʼ�ղ������仯����D����
��ѡ��AB��
��2����ͼ��֪��t0-t1��H2Ũ�ȱ仯��Ϊ0.6mol/L-0.3mol/L=0.3mol/L����v��H2��=$\frac{0.3mol/L}{15s}$=0.02mol/��L•s����
�ʴ�Ϊ��0.02mol/��L•s����
��3����ͼ��֪��t3ʱ��˲�����������ʶ�����������Ӧ����������࣬ƽ��������Ӧ�����ƶ�������ӦΪ���������������ȷ�Ӧ������ѹǿƽ�����淴Ӧ�����ƶ��������¶�ƽ��������Ӧ�����ƶ����ʸı������Ӧ�ǣ������¶ȣ�
�ʴ�Ϊ�������¶ȣ�
��4����ͼ1��֪��ƽ��ʱ������������Ũ�ȷֱ�Ϊ0.6mol/L��0.5mol/L����ƽ��ʱ������Ũ��Ϊ1mol/L-$\frac{2}{3}$��0.3mol/L=0.8mol/L����ƽ�ⳣ��K=$\frac{0��{6}^{3}��0.5}{0��{8}^{2}}$=0.17��
����������ͨ��1.4molNH3��0.8molH2������Ũ�ȱ�Ϊ��0.8+$\frac{1.4}{2}$��mol/L=1.5mol/L��������Ũ�ȱ�Ϊ��0.6+$\frac{0.8}{2}$��mol/L=1mol/L����Ũ����Qc=$\frac{{1}^{3}��0.5}{1��{5}^{2}}$=0.22��0.17��ƽ�������ƶ���
�ʴ�Ϊ��0.17������
��5������Һ������Ũ�ȹ�ϵ����c��NH4+����c��Cl-��ʱ���ɵ���غ��֪c��H+����c��OH-������Һ�������ԣ�
a������㣬��ˮʣ�࣬Ϊ�Ȼ���백ˮ�Ļ����Һ��笠�����ˮ��̶ȴ��ڰ�ˮ�ĵ���ʱ����Һ���ܳ����ԣ���a���ܣ�
b����ˮ������ǡ����ȫ��Ӧ��Ϊ�Ȼ����Һ��笠�����ˮ�⣬��Һ�����ԣ���b���ܣ�
c�������������ҺΪ�Ȼ�李�����Ļ����Һ����Һ�����ԣ���c���ܣ�
��ѡ��abc��
�ڸ��ݵ���غ���c��NH4+��+c��H+��=c��Cl-��+c��OH-��������c��NH4+��=c��Cl-������c��H+��=c��OH-������Һ�����ԣ�����Һ��c��OH-��=10-7mol/L����Һ��c��NH4+��=c��Cl-��=$\frac{1}{2}$��0.1mol•L-1=0.05mol•L-1���ʻ�Ϻ���Һ��c��NH3��H2O��=$\frac{1}{2}$��amol•L-1-0.05mol•L-1=��0.5a-0.05��mol/L��NH3•H2O�ĵ��볣��Kb=$\frac{1{0}^{-7}��0.05}{0.5a-0.05}$=$\frac{1{0}^{-8}}{a-0.1}$��
�ʴ�Ϊ��$\frac{1{0}^{-8}}{a-0.1}$��
���� ���⿼�黯ѧƽ��ͼ��ѧƽ���йؼ��㡢Ӱ�컯ѧƽ������ء���Һ������жϡ�����ƽ�ⳣ�������֪ʶ�㣬�ۺ��Խ�ǿ�����ؿ���ѧ�������жϼ�������������5���е���ƽ�ⳣ���������ѵ㣬��Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +2 | B�� | +4 | C�� | 0 | D�� | +6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
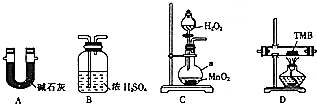 ��̼���⡢������Ԫ����ɵ�TMB��һ������ָ�Ƽ���ɫԭ�Լ�������Է�������Ϊ240��ij�о���ѧϰС���ͬѧ����������װ�òⶨTMB�ķ���ʽ��ʵ��ԭ�����������������н�4.80gTMB��Ʒ��������Ԫ��ת��ΪN2�������������ռ��ֱ�����ˮ������CO2�����ͼ��ѡ���ʵ���װ�ã�����װ�ÿ����ظ�������ʵ�飮
��̼���⡢������Ԫ����ɵ�TMB��һ������ָ�Ƽ���ɫԭ�Լ�������Է�������Ϊ240��ij�о���ѧϰС���ͬѧ����������װ�òⶨTMB�ķ���ʽ��ʵ��ԭ�����������������н�4.80gTMB��Ʒ��������Ԫ��ת��ΪN2�������������ռ��ֱ�����ˮ������CO2�����ͼ��ѡ���ʵ���װ�ã�����װ�ÿ����ظ�������ʵ�飮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | �������ʵ | ���� |
| A | ����������Һ���Գ�ȥβ��NO2 | NO2����������������Һ��Ӧ |
| B | Ư���ڿ����о��ñ��� | Ư���е�CaCl2������е�CO2��Ӧ����CaCO3 |
| C | �ý������Ը��������Һ�Ĺ�����ˮ�����ʼ� | ��������ܻ�ԭˮ���ͷŵĴ������ϩ |
| D | ʩ��ʱ����ľ�ң���Ч�ɷ�ΪK2CO3��������NH4Cl | K2CO3��NH4Cl��Ӧ�����ɰ������ͷ�Ч |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | Ŀ�� | ���� |
| A | ����100mL1.0mol•L-1CuSO4 ��Һ | ��25.0gCuSO4•5H2O��������ˮ���100mL��Һ |
| B | ��ȥKNO3����������NaCl | ��������Ƴ��ȵı�����Һ����ȴ�ᾧ������ |
| C | ������Һ�Ƿ���SO42- | ȡ��������Һ���Թ��У����������ữ��Ba��NO3��2��Һ |
| D | ������Һ���Ƿ���NH4+ | ȡ������Һ���Թ��У�����NaOH���ȣ����Թܿڷ���һƬʪ��ĺ�ɫʯ����ֽ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
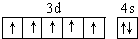 �����仯�����У����������+7��
�����仯�����У����������+7��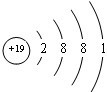 ��
��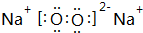 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������л�ԭ�ԣ������������ | |
| B�� | NaHCO3����Ӧ�����������Ƹ������ɼ� | |
| C�� | С�մ�����ᷴӦ������������θ������ҩ�� | |
| D�� | ̼������Һ�Լ��ԣ���������¯����ʱCaSO4������ת���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com