
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 分子式为C5H10O2且遇NaHCO3溶液能产生气体,则该有机物中含有-COOH,所以为饱和一元羧酸,烷基为-C4H9,丁基异构数等于该有机物的异构体数.
解答 解:分子式为C5H10O2且遇小苏达能产生气体,则该有机物中含有-COOH,所以为饱和一元羧酸,烷基为-C4H9,-C4H9异构体有:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,故符合条件的有机物的异构体数目为4.故选:C.
点评 本题主要考查同分异构体书写、官能团的性质与确定等,难度中等,熟练掌握碳原子数小于5的烃基的个数是解决本题的关键,甲基与乙基均1种,丙基2种、丁基4种、戊基8种.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
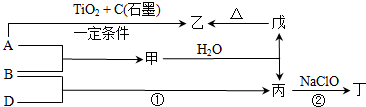
 →
→ ,.
,.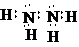 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、Br-、SCN- | B. | NH4+、Na+、CO32-、OH- | ||
| C. | K+、Na+、PO43-NO3- | D. | Al3+、Mg2+、SO42-HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
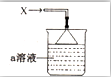 如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )
如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )| A. | 气体X易液化的原因是相对分子质量较大 | |
| B. | W溶液四种离子中两两结合所能形成的离子化合物有两种 | |
| C. | 若a溶液吸收一定量的气体X后,溶液pH=7,此时溶液中有4种溶质 | |
| D. | a溶液中由水电离出的c(H+)=10-13mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
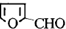 )与丙二酸合成香料过程中发生了
)与丙二酸合成香料过程中发生了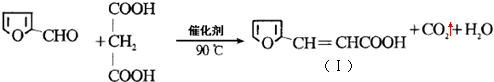
 (或
(或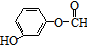 、
、 ).
).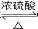 CH3CH2OOCCH2COOCH2CH3+2H2O.
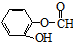
CH3CH2OOCCH2COOCH2CH3+2H2O.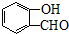 )与丙二酸可发生类似反应①的反应,写出有机产物的结构简式
)与丙二酸可发生类似反应①的反应,写出有机产物的结构简式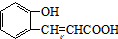 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 软脂酸和油酸互为同系物 | |
| C. | 聚乙烯能使溴水褪色 | |
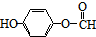
| D. |  分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
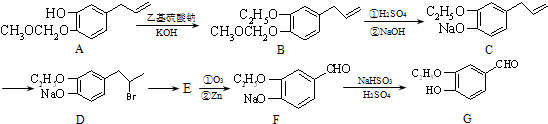
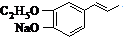 .
.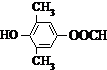 或
或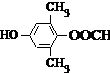 .
.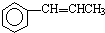 为原料制备
为原料制备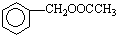 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com