
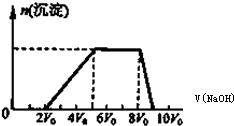
 (1)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里:
(1)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里:| 可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、CO32-、AlO2- |
| 11.2L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、Fe(OH)3中胶粒直径小于1nm |
| B、可以发生丁达尔现象 |
| C、Fe(OH)3能通过滤纸 |
| D、Fe(OH)3胶粒带正电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
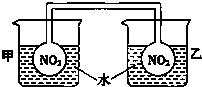 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是
(1)某短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持、加热和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持、加热和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓硝酸 | Cu | NO2 | NaOH溶液 |
| B | 浓氨水 | CaO | NH3 | H2O |
| C | 稀硝酸 | Cu | NO | H2O |
| D | 浓硫酸 | Cu | SO2 | 饱和NaHSO3溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com