
| A. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 家庭中不宜用铝合金容器长期存放咸的食品 | |
| C. | 水处理常用到明矾和漂白粉,但二者的作用原理不同 | |
| D. | 黄河入海口沙洲的形成体现了胶体聚沉的性质 |
分析 A.棉、麻属于纤维素,毛属于蛋白质,合成纤维是以小分子的有机化合物为原料,经加聚反应或缩聚反应合成的线型有机高分子化合物,分子中出C、H元素外,还含有其它元素,如N元素等;
B.根据铝的化学性质与碱反应分析;
C.明矾净水是由于铝离子水解生成氢氧化铝胶体具有吸附性,漂白粉杀菌消毒是因为其具有强的氧化性;
D.胶体遇电解质溶液发生聚沉;
解答 解:A.棉、麻属于纤维素,含有C、H两种元素,完全燃烧只生成CO2和H2O;羊毛属于蛋白质,含有C、H、O、N等元素,完全燃烧除生成CO2和H2O,还有其它物质生成;合成纤维是以小分子的有机化合物为原料,经加聚反应或缩聚反应合成的线型有机高分子化合物,分子中出C、H元素外,还含有其它元素,如N元素等,完全燃烧除生成CO2和H2O,还有其它物质生成,故A错误;
B.铝能与碱性物质反应,所以不宜用铝合金容器长期存放咸的食品,故B正确;
C.明矾净水是由于铝离子水解生成氢氧化铝胶体具有吸附性,漂白粉杀菌消毒是因为其具有强的氧化性,二者原理不同,故C正确;
D.黄河中的泥沙和豆浆都是胶体,胶体遇电解质溶液发生聚沉,故D正确;
故选A.
点评 本题考查铝元素的两性、盐类水解原理、有机物和胶体的性质,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 电器起火,立即用水扑灭 | |
| B. | 炒菜时油锅着火,立即盖上锅盖 | |
| C. | 厨房煤气管道漏气,立即关闭阀门并开窗通风 | |
| D. | 图书管内图书着火,立即用液态二氧化碳灭火器扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| C. | 金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 | |
| D. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
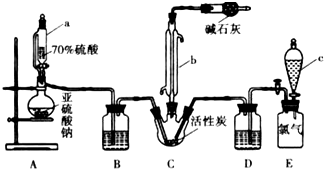 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| B. | 1.7g氨气所含分子数目为0.1NA | |
| C. | 1L 1mol•L-1的Na2SO4溶液中含有Na+的个数为NA | |
| D. | 2g氢气所含氢原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
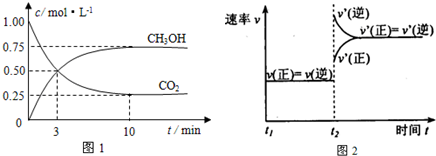
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
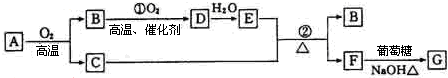
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Cu | 浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com