
| A. | 32g/mol | B. | 165g/mol | C. | 55g/mol | D. | 100g/mol |
科目:高中化学 来源: 题型:选择题
| A. | 粗铜接电源负极 | |
| B. | 纯铜作阳极 | |
| C. | 杂质都将以单质形式沉积到池底 | |
| D. | 纯铜片增重2.56 g,电路中通过电子为0.08 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学学习小组利用下列药品和实验装置测定镁铝合金中镁的质量分数.
某化学学习小组利用下列药品和实验装置测定镁铝合金中镁的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数为ω=$\frac{a}{ρV}$×100% | |
| B. | 溶质的物质的量浓度c=17 V/1 000 a mol•L-1 | |
| C. | 溶液中c(OH-)=V/1 000b mol•L-1 | |
| D. | 上述溶液中再加入V mL水后,所得溶液的质量分数小于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于氧化还原反应 | |
| B. | 反应中Al被氧化,NO3-被还原 | |
| C. | ?内的物质可能是H2O | |
| D. | 若有1molAl参加反应,则有1molNO3-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
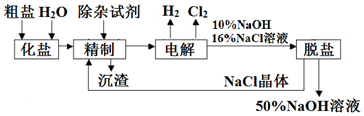
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(ap)}{→}$SiCl4$\stackrel{H_{2}}{→}$Si | |
| B. | FeS2$→_{灼烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,36g 水中所含的氧原子数目为2NA | |
| B. | 在标准状况下,22.4L三氧化硫的物质的量是1mol | |
| C. | 在标准状况下,0.1mol四氯化碳的体积为2.24L | |
| D. | 在标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com