
 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题:分析 (1)碳族元素位于元素周期表的第IVA族,从原子结构角度分析,它们的共同点是最外层上有4个电子;
(2)如图是碳元素的相关信息,其中“2s22p2”表示碳原子的最外层电子排布式,“12.01”是指碳元素的相对原子质量;
(3)根据物理性质判断晶体类型,根据非金属原子间形成共价键分析;
(4)根据价层电子对互斥理论确定微粒空间构型和中心原子杂化方式的判断,正负电荷重心重合的分子是非极性分子,正负电荷重心不重合的是极性分子,SiH4空间构型为正四面体形;非金属性越强氢化物越稳定;
解答 解:(1)碳族元素位于元素周期表的第IVA族,从原子结构角度分析,它们的共同点是最外层上有4个电子,故答案为:第IVA族,最外层上有4个电子;
(2)如图是碳元素的相关信息,其中“2s22p2”表示碳原子的最外层电子排布式,“12.01”是指碳元素的相对原子质量,所以选c;故答案为:碳原子的最外层(价)电子排布式,c;
(3)氮化碳是一种硬度比金刚石还大的晶体材料,则氮化碳具有原子晶体的性质,所以属于原子晶体;非金属原子间形成共价键,所以N与C之间形成共价键;
故答案为:原子晶体;共价键;
(4)根据价层电子对互斥理论确定微粒空间构型和中心原子杂化方式的判断,正负电荷重心重合的分子是非极性分子,正负电荷重心不重合的是极性分子,SiH4空间构型为正四面体形,所以SiH4是非极性分子;非金属性越强氢化物越稳定,碳的非金属性强硅的非金属性,所以稳定性SiH4<CH4,故答案为:非极性;<.
点评 本题考查了分子的极性、晶体类型的判断、核外电子排布等知识点,根据原子结构结合构造原理写核外电子排布式,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol乙烯和乙醇(蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| C. | 含4molSi-O键的二氧化硅晶体中,氧原子数为4NA | |
| D. | 120gNaHSO4固体中含有的离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe-FeCl2-FeCl3-Fe(OH)3 | B. | Al-Al2O3-Al(OH)3-NaAlO2 | ||
| C. | S-SO3-H2SO4-MgSO4 | D. | N2-NO2-NO-HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 标准状况下,2.24L己烷中原子数为2NA | |
| D. | 通常状况下,18g水所含的中子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A | 苯酚钠溶液中通入少量CO2 | 产生白色浑浊 | 2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| B | 在少量稀碳酸钠溶液中逐滴加入稀盐酸至过量. | 开始无气泡,后来有气泡. | CO32-+H+→HCO3- HCO3-+H+→CO2↑+H2O |
| C | 将过量氯化铝溶液逐滴加入到氢氧化钠溶液中 | 先产生白色沉淀而后逐渐溶解 | Al3++3OH-→Al(OH)3↓ Al(OH)3+OH-→AlO2-+H2O |
| D | 向含有酚酞的氢氧化钡溶液中滴加稀硫酸 | 产生白色沉淀,溶液由红色变成无色. | Ba2++OH+H++SO42-→BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SO42-、I-、NO3- | B. | Cu2+、Na+、Cl-、S2- | ||
| C. | Ca2+、K+、HCO3-、NO3- | D. | K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

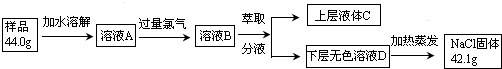

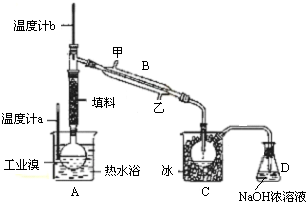
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| B. | 向氟化钠溶液中加入适量氢氟酸,得到的酸性混合溶液:c(Na+)>c(F-)>c(H+)>c(OH-) | |
| C. | 25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌反应,相同时间内HA与Zn反应生成的氢气更多,HA是弱酸 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com