

分析 (1)①磷酸属于弱电解质,第一步电离为主;
②n越大,直链聚磷酸铵极性越弱,水溶性越小;
(2)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,结合电荷守恒、原子守恒配平;
(3)工业白磷 (含少量砷、铁、镁等) 用25%的硝酸、少量合成洗涤剂在75℃时除砷,过滤,得到白磷,滤液回收砷酸、亚砷酸,
①白磷不溶于水,熔化不能改变其毒性,提高温度可以加快反应速率,但温度过高,硝酸会分解;
②为防止白磷被氧化,生产过程在高纯氮气保护下进行;
③除砷过程中,合成洗涤剂起到乳化作用;
④根据信息知砷被硝酸氧化成砷酸,硝酸被还原成NO,然后根据得失电子守恒配平方程式,该反应的化学方程式:3As+5HNO3+2H2O=3H3AsO4+5NO↑;氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少;
⑤硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷.
解答 解:(1)①磷酸属于弱电解质,第一步电离为主,磷酸主要的电离方程式:H3PO4?H2PO4-+H+;
故答案为:H3PO4?H2PO4-+H+;
②n越大,直链聚磷酸铵极性越弱,水溶性越小;
故答案为:小;
(2)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,平衡后方程式为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O,
故答案为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O;
(3)①a.白磷不溶于水,使白磷熔化,提高反应活性,故a正确;b.熔化不能改变其毒性,故b错误;c.温度过高,硝酸会分解,需要控制合适的温度,故c正确;d.提高温度可以加快反应速率,故d正确;
故答案为:acd;
②为防止白磷被氧化,生产过程在高纯氮气保护下进行;
故答案为:防止白磷被空气中氧气氧化;
③除砷过程中,合成洗涤剂起到乳化作用;
故答案为:乳化;
④根据信息知砷被硝酸氧化成砷酸,硝酸被还原成NO,然后根据得失电子守恒配平方程式,该反应的化学方程式:3As+5HNO3+2H2O=3H3AsO4+5NO↑;氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少;
故答案为:3As+5HNO3+2H2O=3H3AsO4+5NO↑;少;
⑤硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低;
故答案为:硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低.
点评 本题以工艺流程为载体,侧重化学基本概念、基本理论,考查了氧化还原反应及离子方程式的配平,等电解质溶液的相关知识,考查学生的知识运用能力、灵活分析处理实际问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇燃烧 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 甲烷和氯气混合,见光 | D. | 用乙醇、乙酸与浓H2SO4混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
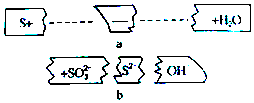
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 该反应可能在酸性条件下进行 | |
| C. | 反应物微粒是S、SO32-、OH- | |
| D. | .2molS参加反应时,转移的电子数为$\frac{8}{3}$ NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
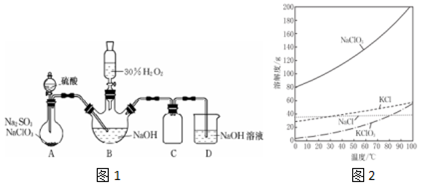
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素随着核电荷数的增大,单质的溶沸点升高 | |
| B. | 卤族元素随着核电荷数的增大,单质的氧化性增强 | |
| C. | HF、HCl、HBr、HI的稳定性依次逐渐减弱 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
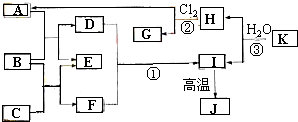 图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).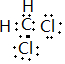 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3•H2O═Al(OH)3↓+3NH4 | |
| B. | 存在于污水中的细菌,常用投加明矾等电解质的方法进行处理 | |
| C. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO═3Mg+Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com