
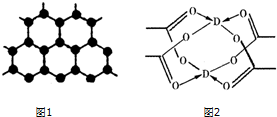
 原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:
原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:分析 原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;B与C可形成正四面体型分子,则C为氯元素;D原子外围电子排布为3d104s1,则D为铜元素.
(1)非金属性越强,电负性越大;金属性越强,第一电离能越小.
(2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高.
(3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键.
(4)由结构图可知,该晶体中含有C-H键、C-C键、配位键.
解答 解:原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;B与C可形成正四面体型分子,则C为氯元素;D原子外围电子排布为3d104s1,则D为铜元素;
(1)氯元素非金属性最强,电负性越大;铜为金属,其它为非金属,所以铜第一电离能最小,故答案为:Cl;Cu;
(2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高,所以HCl的沸点最低,故答案为:HCl;
(3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键,故答案为:sp2;
(4)由结构图可知,该晶体中含有C-H键为极性键、C-C键为非极性键、配位键,故选:①②③.
点评 本题综合性较大,涉及元素推断、核外电子排布规律、晶体结构与化学键、化学用语等,难度中等,是对学生综合能力的考查,学习中注重相关基础的积累理解.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
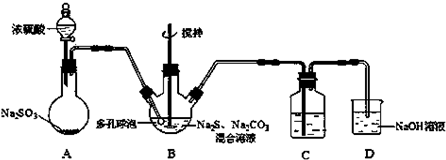
 间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量等级为优 | |
| B. | 二氧化硫的污染指数可能为42 | |
| C. | 目前,我国大部分地区空气中二氧化硫、二氧化氮及可吸入颗粒物等物质的含量偏高 | |
| D. | 对煤、石油等燃料进行脱硫处理、使用氢气等清洁燃料、通过静电沉降器除去悬浮颗粒物都可以治理大气污染,改善空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
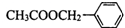 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: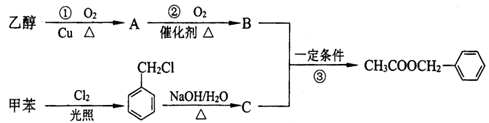

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com