
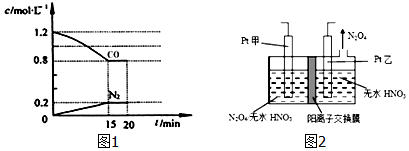
分析 (1)①根据v=$\frac{△c}{△t}$计算v(N2);利用浓度变化量之比等于化学计量数之比计算NO浓度变化量,再根据n=cV计算参加反应NO的物质的量,进而计算NO的转化率;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大;
b.增加CO的量,CO的浓度增大;
c.降低温度,平衡向正反应方向移动;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小;
③温度不变,平衡常数不变,利用三段式计算平衡时各组分的浓度,代入平衡常数K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$,再计算此时浓度商Qc,与平衡常数相比,判断反应进行方向;
(2)根据CO的燃烧热书写CO燃烧的热化学方程式,根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
(3)由图可知,乙电极上有四氧化二氮生成,发生还原反应,则乙为阴极,故甲为阳极,N2O4在阳极失去电子,在硝酸条件下生成N2O5,根据电荷守恒可知,还有氢离子生成.
解答 解:(1)①由图可知,15min N2的浓度变化量为0.2mol/L,浓度变化量之比等于化学计量数之比,则NO浓度变化量为2×0.2mol/L=0.4mol/L,故参加反应的NO为2L×0.4mol/L=0.8mol,故NO的转化率为$\frac{0.8mol}{2mol}$×100%=40%,
故答案为:40%;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大,平衡时CO浓度增大,故a错误;
b.增加CO的量,平衡虽然向正反应方向移动,但CO的转化率减小,到平衡时CO的浓度增大,故b错误;
c.降低温度,平衡向正反应方向移动,到达新平衡时CO的浓度减小,故c正确;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,但CO的物质的量增大程度小于体积增大程度,所以CO浓度减小,
故选cd,
故答案为:cd;
③平衡时氮气浓度变化量为0.2mol/L,NO的起始浓度为$\frac{2mol}{2L}$=1mol/L、CO的起始浓度为$\frac{2.4mol}{2L}$=1.2mol/L,则:
2NO(g)+2CO(g)?2CO2(g)+N2(g)
开始(mol/L):1 1.2 0 0
转化(mol/L):0.4 0.4 0.4 0.2
平衡(mol/L):0.6 0.8 0.4 0.2
故平衡常数K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{0.{4}^{2}×0.2}{0.{6}^{2}×0.{8}^{2}}$L/mol=$\frac{5}{36}$L/mol,
20min时再向容器中充入NO、N2各0.4mol,此时浓度商Qc=$\frac{0.{4}^{2}×(0.2+\frac{0.4}{2})}{(0.6+\frac{0.4}{2})^{2}×0.{8}^{2}}$=$\frac{5}{32}$>K=$\frac{5}{36}$,故反应向逆反应进行,即向左移动,
温度不变,平衡常数不变,即重新达到平衡后,该反应的化学平衡常数为$\frac{5}{36}$L/mol,
故答案为:向左;$\frac{5}{36}$L/mol;
(2)①2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1
②2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1;
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-c kJ•mol-1
根据盖斯定律,①-②+2×③得:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=(-a+b-2c )kJ•mol-1,
故答案为:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=(-a+b-2c )kJ•mol-1;
(3)由图可知,乙电极上有四氧化二氮生成,发生还原反应,则乙为阴极,故甲为阳极,N2O4在阳极失去电子,在硝酸条件下生成N2O5,根据电荷守恒可知,还有氢离子生成,电解池中生成N2O5的电极反应式是:N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阴;N2O4+2HNO3-2e-=2N2O5+2H+.
点评 本题考查化学平衡有关计算、化学平衡移动、化学反应速率计算、平衡常数计算及应用、热化学方程式书写、电解原理及电极反应式书写等,属于拼合型题目,化学平衡常数的有关计算是高考热点,理解掌握化学平衡常数与浓度商的关系确定反应方向,(1)中②为易错点,学生容易根据平衡移动判断浓度变化,注意对平衡移动原理的理解:“减弱改变”而不是“消除改变”,也可以借助平衡常数理解,题目难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 min | B. | 3 min | C. | 6 min | D. | 9 min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
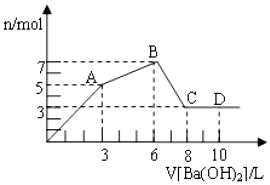 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )| A. | 图中A点生成的沉淀是BaSO4和Al(OH)3 | |
| B. | 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| C. | AB段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO42-═BaSO4↓+2AlO2-+4H2O | |
| D. | 向D点溶液中通入CO2气体,立即产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22Ne的质子数为12 | B. | 20Ne和22Ne的中子数相同 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| B. | 戊烷有4种同分异构体,它们熔点、沸点各不相同 | |
| C. | 油脂发生皂化反应可以得到高级脂肪酸盐与甘油 | |
| D. | 淀粉和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,则下列说法正确的是( )
,则下列说法正确的是( )| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和④ | |
| C. | 发生水解反应时,被破坏的键是① | |
| D. | 发生消去反应时,被破坏的键是②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com