

 .(2分)
.(2分)分析 周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则,则a是H元素,c的最外层电子数为其内层电子数的3倍,原子最外层电子数是8,所以C是O元素,d与c同族,则d是S元素,b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素,再结合原子结构、物质结构、元素周期律解答.
解答 解:周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素,
c的最外层电子数为其内层电子数的3倍,原子最外层电子数是8,所以C是O元素,d与c同族,则d是S元素,
b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;
e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素,
(1)b、c、d分别是N、O、S元素中,元素的非金属性越强,其第一电离能越大,同一周期元素中,第一电离能随着原子序数的增大呈增大趋势,但第VA族元素大于相邻元素,所以N、O、S中第一电离能最大的是N元素,e的价层为3d、4s电子,其电子轨道示意图为 ,
,
故答案为:N; ;
;
(2)a是H元素,a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为氨气,氨气分子中氮原子含有3个共价键和一个孤电子对,所以该分子的中心原子的杂化方式为sp3;分子中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4,
故答案为:sp3;H2O2、N2H4;
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是HNO2、HNO3;酸根呈三角锥结构的酸是H2SO3,
故答案为:HNO2、HNO3;H2SO3;
(4)e和c形成的一种离子化合物的晶体结构如图1,c离子个数=1+8×$\frac{1}{8}$=2,e离子个数=4,所以该化合物为Cu2O,则e离子的电荷为+1,
故答案为:+1;
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明阴离子的中心原子价层电子对个数是4且不含孤电子对,为硫酸根离子,阳离子呈轴向狭长的八面体结构(如图2所示),根据图象知,阳离子的配位数是6,阳离子中含有共价键、配位键,氨分子个数是4、水分子个数是2,其化学式为[Cu(NH3)4(H2O)2]SO4,H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O,
故答案为:SO42-;共价键和配位键;H2O;H2O和Cu2+的配位键比NH3与Cu2+的弱.
点评 本题考查了电子排布式、晶胞的计算、化学键的判断、电离能的比较等知识点,这些知识点都是高考热点,根据晶胞特点、化学键的构成微粒、元素周期律等知识点来分析解答,难点是(5),正确连接图中表示的微粒是解本题关键,知道其配位数及形成的化学键,题目难度中等.


科目:高中化学 来源: 题型:解答题
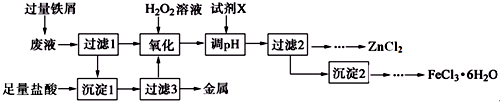
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.2 | 5.4 |
| 完全沉淀pH | 3.7 | 9.6 | 6.9 | 7.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠具有银白色金属光泽,在空气中易变质,生成过氧化钠 | |
| B. | 钠应保存在煤油中 | |
| C. | 钠的化学性质很活泼,在自然界不能以游离态存在 | |
| D. | 钠和钾的合金在室温呈液态,可做原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和D2O | B. | ${\;}_{6}^{12}$C和${\;}_{6}^{14}$C | ||
| C. | H2和D2 | D. | O2和O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 离子方程式 | 单质氧化性 |
| 向NaBr溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层橙红色 | 2Br-+Cl2=2 Cl-+Br2 | Cl2>Br2 |
| 向KI溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Cl2=2 Cl-+I2 | Cl2>I2 |
| 向KI溶液中滴入溴水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Br2=2 Br-+I2 | Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、HCO3-、NO3- | B. | AlO2-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、Fe3+、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、CO32-、OH- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、K+、OH-、Cl- | D. | H+、CO32-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2=Mg2++2Cl- | B. | Fe2(SO4)3=2Fe3++3SO42- | ||
| C. | NaHCO3=Na++H++CO32- | D. | NaOH=Na++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com