
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g),在427 ℃时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/ L,
CO2(g)+H2(g),在427 ℃时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/ L,
(1)计算一氧化碳在此反应条件下的转化率_____________。
(2)若将一氧化碳和水蒸气的浓度都变为0.02 mol/ L,其它条件不变,则达到平衡时,求H2的物质的量浓度_____________?
【答案】 75% 0.015mol·L-1
【解析】(1)设一氧化碳的浓度变化量为xmol/L,则:
CO(g)+H2O(g)H2(g)+CO2(g)
起始量(mol/L):0.01 0.01 0 0
变化量(mol/L):x x x x
平衡量(mol/L):0.01-x 0.01-x x x
则K=![]() =
=![]() =9,解得:x=0.0075,
=9,解得:x=0.0075,
故CO转化率=![]() ×100%=75%;
×100%=75%;
(2)因CO(g)+H2O(g)H2(g)+CO2(g)反应前后物质的量之和不变,则在恒温恒容条件下,一氧化碳和水蒸气的浓度都变为0.02 mol/ L,平衡常数不变,反应物的转化率也不变,达到平衡时H2的物质的量浓度=0.02 mol/ L×75%=0.015mol/L。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是:
A. 离子化合物可能含共价健。
B. 离子化合物中一定不含共价键,阳离子只能是金属离子。
C. 共价化合物可能含离子键。
D. 有化学键断裂就一定有化学键形成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的最外电子层上只有2个电子,该元素是
A. 一定是IIA元素 B. 一定是金属元素
C. 一定是正二价元素 D. 可能是金属元素,也可能是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验Ⅰ 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。

(1)盛放浓盐酸的实验仪器名称是________________。
(2)A中发生反应的化学反应方程式是_______________。
(3)B中生成氯酸钾的离子反应方程式是_____________。
(4)若对调B和C装置的位置,______ (填“能”或“不能”)提高B中氯酸钾的产率,原因是_____________。
实验Ⅱ 测定圆底烧瓶中反应残余液中盐酸的浓度
圆底烧瓶中所发生的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:采用酸碱中和滴定法测定。
乙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列实验:
①进行甲方案实验:准确量取冷却后的残余清液,稀释一定的倍数后作为试样。
a.量取试样20.00mL,用0.10 mol·L—1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00mL,则该次滴定所测的试样中盐酸浓度为__________;
b.重复滴定三次后获得实验结果。
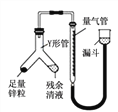
②进行乙方案实验:装置如右图所示(夹持器具已略去)。
(ⅰ)使Y形管中的残余清液与锌粒反应的正确操作是将_________
转移到_________中,否则会造成实验结果偏低。(ⅱ)反应完毕,读取H2的体积,读数时应注意:a.冷却至室温,b.________________ c.视线与凹液面最低处相切。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A. S2和S8的混合物共6.4g,其中所含硫原子数为0.2NA
B. 足量的铜片与含4molHNO3的浓硝酸充分反应生成的二氧化氮的分子数为2NA
C. 5.6g铁粉与硝酸反应失去的电子数一定为0.3 NA
D. 30g甲醛中含有的共用电子对数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在恒容密闭容器中充入N〇2,发生反应2NO2(g)![]() N2O4(g) ΔH<0,达到平衡后,下列说法不正确的是
N2O4(g) ΔH<0,达到平衡后,下列说法不正确的是
A. 再充入少量NO2,达平衡后NO2的转化率增大
B. 再充入少量NO2,达平衡后NO2的体积分数增大
C. 再充入少量N2O4,平衡向逆反应方向移动,达到新平衡后NO2的体积分数减小
D. 升高温度,体系的颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)将原料气按![]() ∶
∶![]() =1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
=1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
① 该反应的平衡常数K随温度升高而__________(填“增大”或“减小”)。
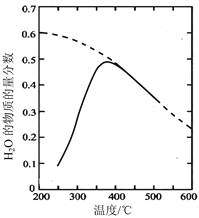
② 温度过高或过低均不利于该反应的进行,原因是________。
③ 200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
① 已知CO2(g)、H2O(g)的生成焓分别为–394 kJmol-1、–242 kJmol-1,Bosch反应的ΔH =________kJmol-1。(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
② 一定条件下Bosch反应必须在高温下才能启动,原因是________。
③ 新方案的优点是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com