
| A、c(SO32-)>c(HSO3-) |
| B、c(K+)=c(HSO3-)>c(OH-)>c(H+) |
| C、c(K+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
| D、c(K+)=c(HSO3-)+c(SO32-)+c(H2SO3) |


科目:高中化学 来源: 题型:
| A、1 | B、2 | C、4 | D、1或4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| C、c(CH3COO- )+c(CH3COOH)=0.1 mol/L |
| D、c(Na+)>c(CH3COO-)>c (H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
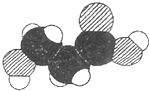
| A、分子中可能含有羟基 |
| B、分子中可能含有羧基 |
| C、该物质的分子式可能为C3H6O3 |
| D、分子中可能含有氨基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙炔的分子结构模型示意图: |
| B、二硫化碳的结构式:S═C═S |
C、NH4Cl的电子式: |
D、2-甲基丁醇的结构简式: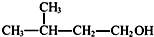 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释后两溶液的pH相等 |
| B、稀释后甲瓶溶液的pH一定小于乙溶液 |
| C、稀释后甲瓶溶液的pH小于或等于乙溶液 |
| D、稀释后甲瓶溶液的pH一定大于乙溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| MnO2 |
| △ |
| 温度 | 200℃ | 300℃ | 400℃ |
| 平衡常数 | K1 | K2 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com