


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
| A、1mol | B、2mol |
| C、2.5mol | D、5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤⑦ | B、②③⑥⑧ |
| C、①⑤⑨ | D、③⑥⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
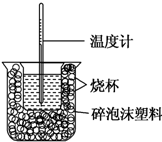 已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:| 反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
| HCl+NaOH | 15.0 | 18.4 | △H1 |
| HCl+NH3?H2O | 15.0 | 18.1 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用铁氰酸钾溶液检验硫酸亚铁铵溶液中的亚铁离子 |
| B、可用淀粉溶液检验海带灰浸出液中的碘元素 |
| C、可用纸层析法分离铁离子与铜离子,分离时,蓝色斑点在棕色斑点的下方,说明铜离子在固定相中分配得更多 |
| D、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN) |
| B、a mol?L-1HCN溶液与b mol?L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、0.1 mol?L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D、NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2SO4 |
| Zn |
| H2SO4 |
| CuO |
| A、消耗等物质的量的Zn、H2SO4、CuO |
| B、所有反应类型都相同 |
| C、过程中产生的ZnSO4质量相同 |
| D、只有CuO消耗的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com