




科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
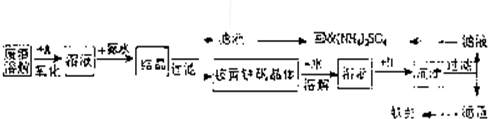
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下:
(1)在废渣溶解操作时,应选用__________溶解(填字母)。
A、氨水 B、氢氧化钠 C、盐酸 D、硫酸
(2)物质A是一种氧化剂,工业上最好选用 (供选择使用的有:空气、Cl2、MnO2),其理由是 。
(3)根据下图有关数据,你认为工业上氧化操作时应控制的条件是: 。
(4)“结晶”反应的化学方程式为_________________ ____________________。
(5)简述检验“滤液”中含有NH4+的实验方法: 。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省泰州中学高三上学期期中考试化学试卷(带解析) 题型:填空题
(12分)工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
(1)在废渣溶解时需要使用酸,应选用__________,为了提高废渣的浸取率,可采用的措施有哪些?
_____________________________________________________________(至少写出两点)。
(2)物质A是一种氧化剂,工业上最好选用_____________(供选择使用的有:空气、Cl2、MnO2),其理由是 (至少写出两点)。
(3)“结晶”反应的化学方程式为__________________________________________________。
(4)上述生产流程中多处采用了过滤操作,实验室中完成相应的操作需要用到的玻璃仪器有烧杯及____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com