
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
分析 依据化学平衡三段式列式计算分析判断,容器的体积可变,则气体的物质的量与容器容积成正比,故气体密度之比与气体总物质的量成反比,据此列式讨论出a、b的关系即可.
解答 解:1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)?b Z(g).反应达到平衡后,测得X的转化率为25%,
X(g)+a Y(g)?b Z(g).
起始量(mol) 1 a 0
变化量(mol) 0.25 0.25a 0.25b
平衡量(mol) 0.75 0.75a 0.25b
依据在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比得到,在同温同压下测得反应前混合气体的密度是反应后混合气体密度的$\frac{5}{6}$,即反应后气体物质的量是反应前气体物质的量$\frac{5}{6}$,
则(0.75+0.75a+0.25b):(1+a)=5:6,整理可得:3b=a+1,
依据选项中的数据可知a=2,b=1符合,
故选B.
点评 本题考查了化学平衡的计算,题目难度中等,混合气体密度之比在相同条件下和气体物质的量成反比是应用的主要计算依据,注意掌握三段式在化学平衡计算中的应用,酸脱培养了学生的化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 由反应①②可计算出CH3OH的燃烧热 | |
| B. |  反应②中的能量变化如图所示 | |
| C. | 可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ•mol-1 | |
| D. | 可推知CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | .KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| C. | .NaCl溶液(Br2):加CCl4,分液 | |
| D. | .FeSO4溶液(CuSO4):加过量铁粉、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
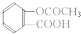

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++SO32-+H2O | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com