
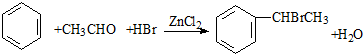 (卤烷基化反应)
(卤烷基化反应)
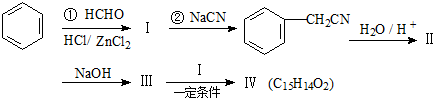
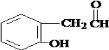 ,
, .
.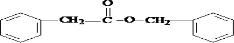 .
.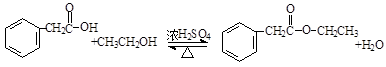 .
.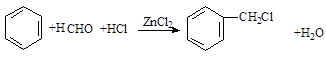 .
. 分析  与HCHO发生信息中的卤烷基化反应生成Ⅰ:
与HCHO发生信息中的卤烷基化反应生成Ⅰ: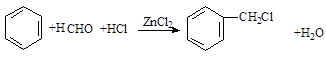 ,则Ⅰ为
,则Ⅰ为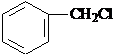 ;Ⅱ是羧酸,结合转化关系可知Ⅱ为
;Ⅱ是羧酸,结合转化关系可知Ⅱ为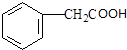 ;
;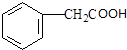 与氢氧化钠溶液反应生成Ⅲ,则Ⅲ为
与氢氧化钠溶液反应生成Ⅲ,则Ⅲ为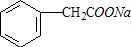 ;Ⅰ
;Ⅰ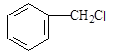 和Ⅲ
和Ⅲ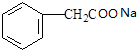 发生信息反应后生成Ⅵ,则Ⅵ的结构简式为:
发生信息反应后生成Ⅵ,则Ⅵ的结构简式为: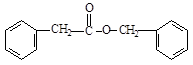 ,据此进行解答.
,据此进行解答.
解答 解: 与HCHO发生信息中的卤烷基化反应生成Ⅰ:
与HCHO发生信息中的卤烷基化反应生成Ⅰ: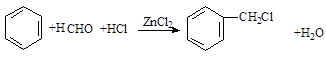 ,则Ⅰ为
,则Ⅰ为 ;Ⅱ是羧酸,结合转化关系可知Ⅱ的结构简式为:
;Ⅱ是羧酸,结合转化关系可知Ⅱ的结构简式为: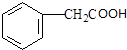 ;
;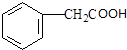 与氢氧化钠溶液反应生成Ⅲ,则Ⅲ的结构简式为:
与氢氧化钠溶液反应生成Ⅲ,则Ⅲ的结构简式为: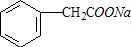 ;Ⅰ
;Ⅰ 和Ⅲ
和Ⅲ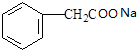 发生信息反应后生成Ⅵ,则Ⅵ的结构简式为:
发生信息反应后生成Ⅵ,则Ⅵ的结构简式为: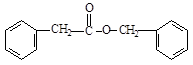 ,
,
(1)根据取代反应的定义是有机物分子里的原子或原子团被其他原子或原子团代替的反应,苯环上的一个氢原子被-CH2Cl代替,该反应为取代反应,
故答案为:取代反应;
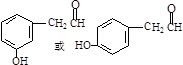
(2)根据题意化合物Ⅱ的结构简式是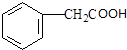 ,它的同分异构体要求a.能与FeCl3溶液作用显紫色说明还有酚羟基,b.能发生银镜反应s说明含有醛基c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为1:2:1,说明除苯环外还有三种氢原子且个数比为1:2:1,醛基和酚羟基都是一个氢原子,所以另外的一个碳上是两个氢,这个碳必须和醛基相连写出
,它的同分异构体要求a.能与FeCl3溶液作用显紫色说明还有酚羟基,b.能发生银镜反应s说明含有醛基c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为1:2:1,说明除苯环外还有三种氢原子且个数比为1:2:1,醛基和酚羟基都是一个氢原子,所以另外的一个碳上是两个氢,这个碳必须和醛基相连写出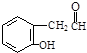 再根据苯环上两取代基邻间对的位置关系写出满足条件的有机物的结构简式为:
再根据苯环上两取代基邻间对的位置关系写出满足条件的有机物的结构简式为: 、
、 ,
,
故答案为: ;
; ;
;
(3)1molC15H14O2完全燃烧生成CO2和H20,需消耗O2的物质的量为:(15+$\frac{14}{4}$-$\frac{2}{2}$)=17.5mol;根据提示Ⅰ 和Ⅲ
和Ⅲ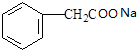 ,两者反应后生成Ⅵ:
,两者反应后生成Ⅵ: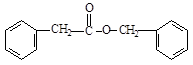 ,
,
故答案为:17.5;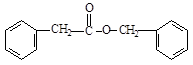 ;
;
(4)化合物Ⅱ的结构简式为: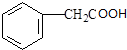 ,
,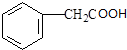 与乙醇发生酯化反应,该反应的化学方程式为:
与乙醇发生酯化反应,该反应的化学方程式为: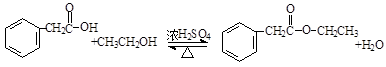 ,
,
故答案为: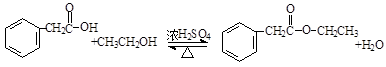 ;
;
(5)结合提示可知在①反应中醛基的碳氧双键断裂,碳一端连接苯环一端连接卤原子: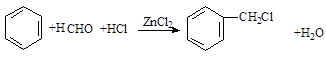 ,
,
故答案为: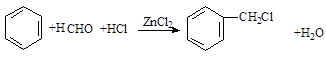 .
.
点评 本题考查有机推断,题目难度较大,涉及有机分子的同分异构体的书写、提示信息的提取利用、化学方程式书写、有机物结构与性质等知识,(2)为难点,明确同分异构体的书写原则及有机物结构与性质为解答关键.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 含共价键的共价化合物一定是分子晶体,分子晶体一定含共价键 | |
| B. | 固态可以导电的是离子晶体和金属晶体 | |
| C. | 由原子构成的晶体一定是原子晶体,由分子构成的晶体一定是分子晶体 | |
| D. | 判定晶体为离子晶体还是分子晶体的方法是看其熔融态是否能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
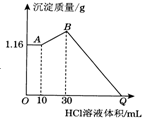 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了测定某有机物A的结构,做如下实验:
为了测定某有机物A的结构,做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. | 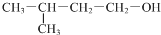 的名称:3-甲基-1-丁醇 的名称:3-甲基-1-丁醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com