

分析 (1)该反应需要氧气参加,反应物熔融状态下搅拌目的是使熔融物充分接触空气;由题目信息可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水,根据电子得失、原子守恒进行配平;
(2)陶瓷、石英原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应:SiO2+2KOH═K2SiO3+H2O;
(3)步骤c中反应中硫酸和K2MnO4生成棕褐色沉淀MnO4和KMnO4,根据质量守恒确定其他产物,利用电子得失守恒和原子守恒配平;
(4)从溶液中得到固体的实验操作一般为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)母液中含有硫酸钾,循环使用,导致K2SO4逐渐积累,结晶时随产品析出,产品不纯;
(6)以KClO3为氧化剂还原产物为KCl,溶解酸化时,Cl-被氧化生成氯气,从而污染环境.
解答 解:(1)步骤a中,反应物熔融状态下搅拌的目的是:使熔融物充分接触空气;由题目信息可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水,反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为:2MnO2+4KOH+O2$\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
故答案为:使熔融物充分接触空气;2MnO2+4KOH+O2$\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
(2)陶瓷、石英原料含有SiO2,在高温下,陶瓷、石英可以和KOH发生反应:SiO2+2KOH═K2SiO3+H2O,腐蚀反应釜,故不能使用陶瓷反应釜和石英反应釜,而使用铁制反应釜;
故选:C;
(3)步骤c中反应中硫酸和K2MnO4生成棕褐色沉淀MnO2和KMnO4,根据元素守恒还应生成水,反应中锰元素由+6价升高为+7价,升高1价,由+6价降低为+4价,降低2价,化合价升降最小公倍数为2,所以MnO2系数2,MnO4-系数为1,根据锰元素守恒确定MnO42-系数为3,根据电荷守恒确定H+系数为4,根据氢元素守恒确定H2O系数为2,所以离子化学方程式为:3MnO42-+4H+$\frac{\underline{\;熔融\;}}{\;}$2MnO4-+MnO2+2H2O;
故答案为:3MnO42-+4H+$\frac{\underline{\;熔融\;}}{\;}$2MnO4-+MnO2+2H2O;
(4)从滤液中得到KMnO4晶体的实验操作依次是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)母液中含有硫酸钾,循环使用,导致K2SO4逐渐积累,结晶时随产品析出,降低高锰酸钾纯度,
故答案为:导致K2SO4逐渐积累,结晶时随产品析出,降低高锰酸钾纯度;
(6)以KClO3为氧化剂还原产物为KCl,溶解酸化时,Cl-被氧化生成氯气,从而污染环境,
故答案为:以KClO3为氧化剂会使滤渣中含有大量KCl,溶解酸化时,Cl-被氧化会产生大量氯气.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、物质推断、氧化还原反应等,难度中等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
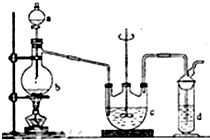 硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色污染是指聚乙烯、聚氯乙烯等塑料垃圾 | |
| B. | 吗啡、海洛因等虽然有麻醉、止痛、镇静作用,但易上瘾且有害,它们属于毒品 | |
| C. | 青霉素等抗生素对病原体有抑制和杀灭作用,这是“治本”而不是“治标” | |
| D. | 为保证人体所需要的足量的蛋白质我们应多吃肉,少吃蔬菜和水果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com