
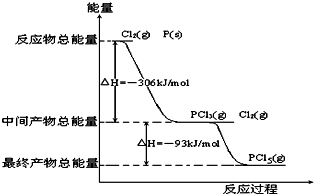
分析 (1)△H=生成物总能量-反应物总能量,结合图分析焓变,热化学方程式中物质的量与热量成正比;升高温度,平衡向吸热的方向移动;
(2)制备PCl5的反应为放热反应,降低温度有利于制备PCl5;
(3)热化学方程式书写要求:注明各物质的聚集状态,结合图判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系;由盖斯定律可知,反应一步完成与分步完成的热效应相同.
解答 解:(1)△H=生成物总能量-反应物总能量,Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,所以 PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式:PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol,
PCl5分解率α1=$\frac{0.8mol-0.6mol}{0.8mol}$×100%=25%.PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;升高温度向吸热反应方向移动,正反应(分解反应是吸热反应)是吸热反应,升高温度向正反应方向移动,转化率增大,α2 >α1 ;
故答案为:25%;大于;
(2)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:两步反应均为放热反应,降低温度有利于提高产率,防止产物分解;
(3)由图可知P(s)+Cl2(g)→PCl5(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol+(-93KJ/mol)=-399KJ/mol,热化学方程式为:P(s)+$\frac{5}{2}$Cl2(g)═PCl5(g)△H=-399kJ/mol;由盖斯定律可知P和Cl2一步反应生成1molPCl5的△H4等于△H3,
故答案为:-399kJ/mol; 等于.
点评 本题考查化学平衡的计算,为高频考点,把握图象分析、热化学方程式、盖斯定律及转化率计算为解答的关键,侧重分析与及计算能力的考查,注意图象分析与平衡移动原理的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,4.4g乙醛所含σ键数目为0.7 NA | |
| C. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
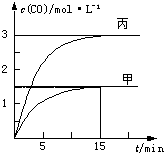 一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )| 容 器 | 甲 | 乙 | 丙 |
| 容 积 | 0.5L | 0.5L | V |
| 温 度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.2mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5(mol•L-1) | |
| D. | 乙容器中,若平衡时n(H2O)=0.4mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要意义.
研究CO2的利用对促进低碳社会的构建具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 | |
| B. | 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深 | |
| C. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 | |
| D. | 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | $\frac{1}{3}$ | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S水解:S2-+2 H2O?H2S+2OH- | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 向次氯酸钙溶液通入过量CO2:Ca2++2CIO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2CIO-+H2O+SO2═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 说法1 | 说法2 | 判断 |
| A | Na+、Mg2+、O2-、F-中离子半径最大的是O2- | I的原子半径大于Br,HI比HBr的热稳定性强 | 说法1说法2均正确 |
| B | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | 热稳定性:HCl>HI | 说法1说法2均正确 |
| C | 原子半径:Na>Mg | 酸性:H2SO3>H2SO4 | 说法1说法2均错误 |
| D | 同主族元素的简单阴离子还原性越强,水解程度越大 | 同周期金属元素的化合价越高,其原子失电子能力越强 | 说法1错误说法2正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com