
对于反应2SO2(g)+O2(g)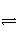
 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.π键是由两个p电子以“头碰头”方式重叠而成
B.1molC2H2中有4molσ键
C.乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D.H2分子中含σ键,Cl2分子中含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
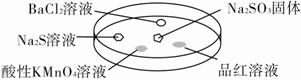
下表中对实验现象的描述或所做的解释不正确的是( )。
| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
咖啡酸是一种在医学上具有较广泛的应用的医药中间体和原料药。
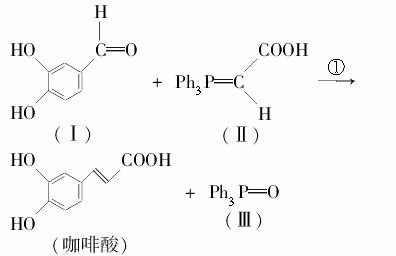
咖啡酸苯乙酯是一种天然抗癌药物,由苯乙烯合成咖啡酸苯乙酯的过程之一是:

(1)化合物Ⅰ的分子式为________;反应③的反应类型为________反应。
(2)若化合物Ⅱ和Ⅲ中的“Ph”为苯基、“P”为磷原子,则化合物Ⅱ的结构简式为________________;咖啡酸苯乙酯的键线式结构简式为________________。
(3)足量的溴水与咖啡酸发生反应的化学方程式为__________________________________________
__________________________________________。
(4)下列说法错误的是________。
A.化合物Ⅰ能发生银镜反应
B.苯乙烯发生加聚反应生成热固性塑料
C.苯乙醇能使酸性高锰酸钾溶液褪色
D.镍催化下,1 mol咖啡酸最多可加成4 mol H2

查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于催化剂的说法,正确的是( )
A.催化剂能使不起反应的物质发生反应
B.催化剂在化学反应前后,化学性质和质量都不变
C.催化剂不能改变化学反应速率
D.任何化学反应,都需要催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
设C+CO2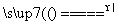 2CO,正反应是吸热反应,反应速率为v1。N2+3H2
2CO,正反应是吸热反应,反应速率为v1。N2+3H2
 2NH3,正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
2NH3,正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加碳的量③通入CO2④恒容下充入N2⑤恒压下充入N2
能够使反应速率增大的措施是( )
A.①④ B.②③⑤ C.①③ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
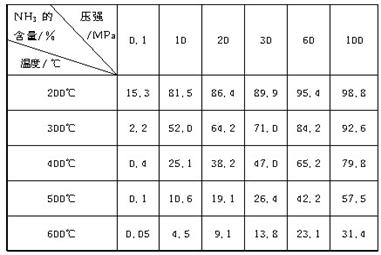
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向____________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)计算500℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2S水溶液中存在电离平衡H2SH++HS-和HS-H++S2-。若向H2S溶液中 ( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com