
钛号称“崛起的第三金属”,被广泛应用于军事、医学等领域。已知钛有48Ti、49 Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
A. 钛元素在周期表中处于第四周期ⅡB族 B. 上述钛原子中,中子数不可能为22
C. 钛原子的外围电子层排布为3d24s2 D. 钛元素位于元素周期表的d区,是过渡元素
科目:高中化学 来源:广西南宁市2017届高三第一次模拟测试理综化学试卷 题型:填空题
铜、硫的单质及其化合物在生产、生活中应用广泛,辉铜矿(主要成分是Cu2S)是冶炼铜和制硫酸的重要原料。
(1)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ/mol
②2Cu2O(s)+ Cu2S(s)=6Cu(s)+ SO2(g) △H=+116.0kJ/mol
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=__________。
(2)利用化石燃料开采、加工过程产生的H2S废气可制取氢气,既廉价又环保,若得到56L(标准状况)氢气,则转移的电子属为________。
(3)上述冶炼过程中会产生大量的SO2,回收处理SO2不仅能防止环境污染,而且能变害为宝。回收处理的方法之一是先将SO2转化为SO3,然后再转化为H2SO4。
①450℃时,某恒容密闭容器中存在反应:2SO2(g)+O2(g) 2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。
2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。
A.容器内气体密度不变 B.O2、SO2的消耗速率之比为1:2
C.n(SO2):n(O2):n(SO3)=2:1:2 D.容器内压强不再发生交化
②450℃、0.1Mpa下,将2.0molSO2和1.0molO2置于5L密闭容器中开始反应,保持温度和容器体积不变,SO2的转化率(a)随着时间(t)的变化如图1所示。则该温度下反应的平衡常数K=_____。若维持其他条件不变,使反应开始时温度升高到500℃ ,请在图l中画出反应从开始到平衡时SO2转化率的变化图像_______。
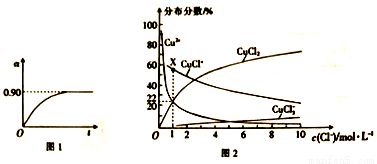
(4)已知CuCl2溶液中,铜元素的存在形式与c(Cl-)的相对大小有关,具体情况如图2所示(分布分数是指平衡体系中各含铜微粒物质的量占铜元素总物质的量的百分比)。
①若溶液中含铜微粒的总浓度为amol/L,则X点对应的c(CuCl+)=___________ (用含a的代数式表示)。
②向c(Cl-)=1mol/L的氯化铜溶液中滴人少量AgNO3溶液,则浓度最大的含铜微粒发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:实验题
甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在下图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50mL和5 mol·L-1NaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
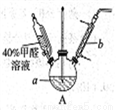
①仪器b的名称是___________,作用为__________。
②能说明甲醛具有还原性的实验现象是___________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。
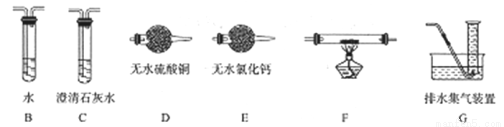
依次连接的合理顺序为A→B→___→___→___→___G,装置B的作用是_________。
(3)已知: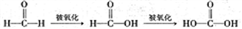 。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);
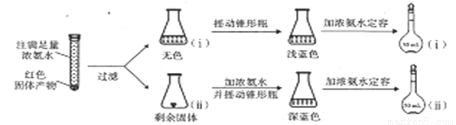
已知:Cu2O [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+](蓝色)。
[Cu(NH3)4]2+](蓝色)。
①摇动锥形瓶ⅰ的目的是_____________。
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液的离子方程式为______________。
③将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近。由此可知固体产物的组成及物质的量之比约为_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.CS2是极性键构成的极性分子
B.SO2与CO2为等电子体
C.金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高
D.1molNaHSO4熔融态时有3mol离子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
高温下,某反应达到平衡,平衡常数K=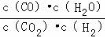 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
下列原子外围电子层的电子排布图正确的是( )
A. O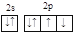 B. Fe
B. Fe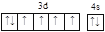
C. Si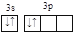 D. Cr
D. Cr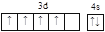
查看答案和解析>>
科目:高中化学 来源:山东省2016-2017学年高一3月月考化学试卷 题型:选择题
法国里昂的科学家最近发现一种只由四个中子构成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”微粒的说法不正确的是
A.该微粒不显电性 B.该微粒质量数为4
C.与氢元素的质子数相同 D.该微粒质量比氢原子大
查看答案和解析>>
科目:高中化学 来源:2017届陕西省咸阳市高三二模理综化学试卷(解析版) 题型:填空题
(1)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,该物质中存在的化学键有离子键、
_____和_____;含有的Fe3+的核外电子排布式为______。
(2)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是____;碳原子采取sp杂化,1mol该物质中含有的π键数目为______。含有的三种非金属元素的电负性由大到小的顺序是______。
②H2O2常温下是液体,沸点较高(150℃),其主要原因是______。
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下左图,As原子的杂化方式为___,雌黄和SnCl2在盐酸中反应转化为雌黄(As4S4)和SnCl4,SnCl4分子的空间构型为______。
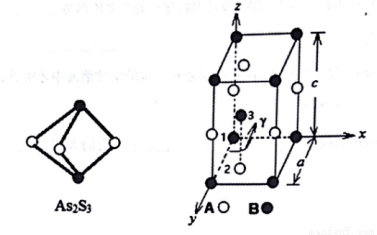
(4)某晶体的晶胞结构如上右图所示,该晶体的化学式为_____,该晶胞参数为a=250.4pm,c=666.1pm,y=120o;1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),则3号原子坐标为_____,计算上述晶体中A和B两原子间的最小核间距为____。(保留四位有效数字。已知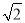 =1.141,
=1.141, 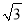 =1.732.)
=1.732.)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
X、Y、Z、W、R是原了序数依次递增的短周期元素。X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是X核外电子数的4倍,Z为短周期中金属性最强的元素,W是地売中含量最高的金属元素。下列叙述正确的是
A. Y、Z、W原子半径依次增大
B. X的最高价氧化物对应水化物的酸性比R的强
C. X、R分别与Y形成的常见化合物中化学键类型相同
D. 元素W、R的简单离子具有相同的电子层结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com