
| A. | 中性食品 | B. | 碱性食品 | C. | 弱碱性食品 | D. | 酸性食品 |
科目:高中化学 来源: 题型:解答题
 一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:
一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色的溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在pH=11的溶液中:CO32-、Na+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol•L?1的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 在酸性溶液中:Na+、NH4+、SO42-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
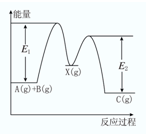 反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )| A. | △H=E1-E2 | B. | E1是反应①的活化能 | ||
| C. | X是反应A(g)+B(g)→C(g)的催化剂 | D. | △H2>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
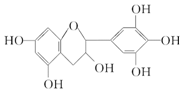
| A. | 分子式为C15H16O7 | |
| B. | 1 mol儿茶素A在一定条件下最多能与6 mol H2加成 | |
| C. | 等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应消耗金属钠和氢氧化钠的物质的量之比为1:1 | |
| D. | 1 mol儿茶素A与足量的浓溴水反应,最多消耗Br2 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 1 mol•L-1 NaCl溶液 | B. | 100mL2 mol•L-1 AlCl3溶液 | ||
| C. | 100mL1 mol•L-1 NH4Cl溶液 | D. | 150mL2 mol•L-1 KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和溶液的密度$\frac{(a+b)}{V}$ | |
| B. | 饱和溶液的物质的量浓度$\frac{100a(M-18x)}{MV}$ | |
| C. | 25℃,R的溶解度$\frac{100a(M-18x)}{(bM+18ax)}$ | |
| D. | 饱和溶液的质量分数$\frac{a(M-18x)}{(a+b)M}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
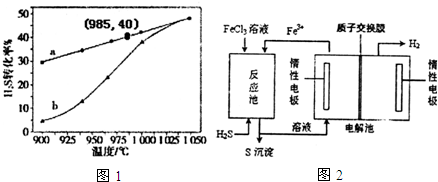
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com