
【题目】(双选)下列各组离子中,中心原子的杂化轨道类型相同的是( )
A. NO、ClO B. SO![]() 、CO
、CO![]() C. NH、PH D. SO
C. NH、PH D. SO![]() 、SO
、SO![]()
【答案】CD
【解析】可以由VSEPR模型来判断离子的立体构型,再判断杂化轨道类型。A、NO中N原子上无孤电子对[ (5+1-3×2)=0],ClO中Cl原子上孤电子对数为1[ (7+1-3×2)=1],分别为平面三角形和三角锥形,N、Cl原子采取sp2和sp3杂化,选项A不选;B、SO![]() 中S原子上孤电子对数为1、CO
中S原子上孤电子对数为1、CO![]() 中C原子上无孤电子对,S、C原子分别采取sp3、sp2杂化,选项B不选;C、NH中N原子上孤电子对数为0、PH中S原子上孤电子对数为0,N、P原子均为sp3杂化,选项C选;D、SO
中C原子上无孤电子对,S、C原子分别采取sp3、sp2杂化,选项B不选;C、NH中N原子上孤电子对数为0、PH中S原子上孤电子对数为0,N、P原子均为sp3杂化,选项C选;D、SO![]() 中S原子上孤电子对数为1、SO
中S原子上孤电子对数为1、SO![]() 中S原子上孤电子对数为1,SO
中S原子上孤电子对数为1,SO![]() 、SO
、SO![]() 中S原子均为sp3杂化,选项D选。答案选CD。
中S原子均为sp3杂化,选项D选。答案选CD。


科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂。以钼精矿(主要成分为MoS2)为原料制备金属钼和钼酸钠晶体的主要流程如图所示。
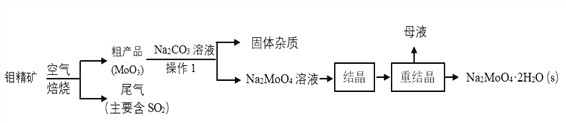
(1)Na2MoO4·2H2O 中钼元素的化合价为____________;
(2)在焙烧反应中,每生成1mol MoO3时转移电子数为:_______ (以NA表示阿伏加德罗常数的值);
(3)操作1中,粗产品中的MoO3与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为_____;
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______________________________________;
(5)结晶操作前需加入Ba(OH)2固体以除去溶液中的SO42-,SO42-的最大去除率是_____(结果保留一位小数)[已知:碱浸液中c(MoO42-)=0.80mol·L-1,(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=4.0×10-8,Ba(OH)2引起的溶液体积变化忽略。]
(6)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
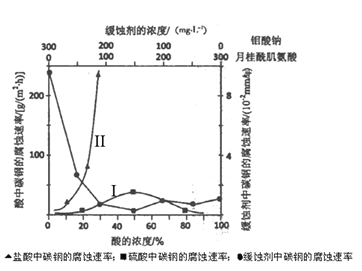
①试分析I、II曲线变化趋势不同的原因________________________________________
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________________________________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的价类二维图,其中的箭头 表示部分物质间的转化关系,下列说法正确的是( )
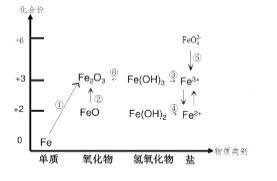
A. 铁与高温水蒸气的反应可实现上述转化①
B. FeO 是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末
C. 由图可预测:高铁酸盐( FeO42- )具有强氧化性,可用于消毒。FeO42- 与水反应最终可生成 Fe(OH)3胶体,从而吸附水中的悬浮物,故高铁酸盐可用做净水剂
D. 加热 Fe(OH)3 发生转化⑥,加水溶解可实现转化③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)化合物 Mg5Al3(OH)19(H2O)4 可作环保型阻燃材料,受热时按如下化学方程式分解:2 Mg5Al3(OH)19(H2O)4 = 27H2O↑+10MgO+3A12O3
①写出该化合物作阻燃剂的依据_____
②用离子方程式表示除去固体产物中 A12O3 的原理_____。
(2)镁燃烧不能用 CO2 灭火,用化学方程式表示其理由_____。
(3)铝的亲氧性,可表现在铝能夺取化合物中的氧,例如 2Al+Fe2O3=Al2O3+2Fe。且反应放出大量的热,在冶金学上称为铝热反应。取少量铝热反应所得的固体混合物,将其溶于足量稀硫酸,滴加KSCN 溶液无明显现象,_____(填“能”或“不能”)说明固体混合物中无 Fe2O3,理由是_____、_____(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:
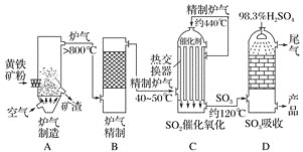
请回答下列问题:
(1)在炉气制造中,黄铁矿粉碎的目的是____________,生成二氧化硫的化学方程式是_____________。
(2)炉气精制的目的是__________________________________。
(3)二氧化硫催化氧化的化学方程式是________________________。
(4)浓硫酸是不是可以用水代替:__________,原因是__________________________________。
(5)尾气的主要成分是__________,若将尾气通入氢氧化钙浊液中,最后能得到的副产品是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A.1:2
B.1:4
C.3:4
D.3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com