
【题目】如图是向10mLAgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).已知:pAg=﹣lg{c(Ag+)},Ksp(AgCl)=1×10﹣12 . 根据图象所得下列结论正确的是( )(提示:Ksp(AgCl)>Ksp(AgI)) 
A.原AgNO3溶液的物质的量浓度为0.1 molL﹣1
B.图中x点的坐标为(100,6 )
C.图中x点可认为溶液中Ag+被沉淀完全
D.把0.1 molL﹣1的NaCl换成0.1 molL﹣1NaI则图象在终点后变为虚线部分
【答案】B
【解析】解:A、图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 molL﹣1 , 即原AgNO3溶液的物质的量浓度为1 molL﹣1 , 故A错误;
B、x点c(Ag+)=10﹣6 molL﹣1 , 一般认为溶液中离子浓度小于10﹣5 molL﹣1 , 即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1molL﹣1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故B正确;
C、x点c(Ag+)=10﹣6 molL﹣1 , 一般认为溶液中离子浓度小于10﹣5 molL﹣1完全沉淀,实际上Ag+没有完全沉淀,故C错误;
D、与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 molL﹣1的NaCl换成0.1molL﹣1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )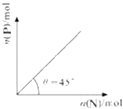
A.平衡时N的转化率为50%
B.当温度升高后,则图中θ>45°
C.若再加入N,则正、逆反应速率均逐渐增大
D.若在加入N,则反应体系中气体密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
(1)写出下列仪器的名称:a.
(2)利用装置I分离四氯化碳和酒精的混合物时,冷凝水由(填f或g)口出来.
(3)现需配制0.1mol/LNaOH溶液500mL,装置II是某同学转移溶液的示意图.
①图中的错误是 .
②配制溶液时,其正确的操作顺序是(用字母表示,每个字母只能用一次) .
A.将容量瓶盖紧,振荡,摇匀 B.改用胶头滴管加水,使溶液凹面恰好与刻度相切
C.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
D.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③配制溶液时下列操作会造成所配溶液浓度偏小的是
A.称量后转移固体时不小心把少量固体洒到烧杯外
B.干净的容量瓶又用蒸馏水洗涤了一遍 C.加水定容时,俯视容量瓶刻度线读数
D.转移过程中不小心把几滴溶液滴在外面 E.未冷却就转移.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的转化关系如下图所示,A是一种高熔点金属氧化物,D是一种红棕色固体.
回答下列问题:
(1)填写下列物质的化学式:A;B;D;H .
(2)写出下列反应的方程式:①C+D→A+E的化学方程式: .
②A→H的离子方程式: .
③F→G的化学方程式:、 .
(3)F→G反应现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融LiCO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )
A.以此电池为电源精炼铜,当有0.1mole﹣转移时,有3.2g铜溶解
B.若以甲烷为燃料气时负极反应式:CH4+5O2﹣﹣8e﹣=CO32﹣+2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生电极反应式为:O 2+4e﹣+2CO2=2CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.实验室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境.某化学兴趣兴趣小组尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮.有关物质信息、实验流程如图1及实验装置如图2如下:环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,相对水的密度:0.95,熔点:﹣45℃,沸点:155℃,溶解度(100mL H2O):2.4g (31℃ ). 回答下列问题:
回答下列问题:
(1)仪器A的名称是 .
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有、 .
(3)加入饱和NaHSO3溶液时发生的主要反应是(用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是 .
(4)为将馏出液的pH调至中性,可以加入的试剂是 .
A.稀盐酸
B.无水碳酸钠
C.浓硫酸
D.氢氧化钠固体
(5)调节pH后还需加入精制食盐,其目的是 , “取有机层”时使用的主要仪器是 . (填图3对应的字母).
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究.他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定.具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3═2NaI+Na2S4O6 . 则该NaClO溶液的浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰箱制冷剂氟氯甲烷在高空受紫外线辐射时产生Cl·原子,并能发生下列反应:Cl·+O3―→ClO·+O2 , ClO·+O·―→Cl·+O2。下列说法不正确的是( )
A.反应过程中将O3转变为O2
B.Cl是总反应的催化剂
C.氟氯甲烷是总反应的催化剂
D.Cl起分解O3的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.电解质溶液导电为化学变化
B.Na、SiO2、H2O都称为分子式
C.NH3的水溶液能导电,所以NH3为电解质
D.HClO、KNO3、H2O2中均含离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com