
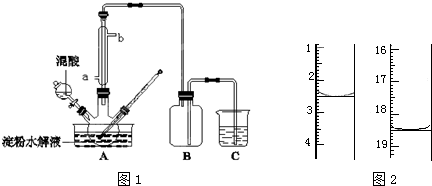
分析 (1)根据浓硫酸的三大特性结合反应解答;
(2)冷凝效果逆流效果好;浓硫酸溶于水放热;草酸具有还原性,硝酸能进一步氧化C6H12O6和H2C2O4;
(3)碘水遇到淀粉会变蓝,如果溶液中无淀粉,加入碘水没有变化;
(4)布氏漏斗与吸滤瓶配套,用于无机制备中晶体或粗颗粒沉淀的减压过滤;
(5)优点:提高HNO3利用率(或循环使用氮氧化物); 缺点:NOx(或氮氧化物)吸收不完全;
(6)高锰酸钾为紫红色,过程中不需要加指示剂;在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,根据反应计算.
解答 解:(1)浓硫酸具有强氧化性、吸水性和脱水性,本题实验是将C6H12O6用硝酸氧化可以制备草酸,浓硫酸作催化剂且浓硫酸吸水有利于向生成草酸的方向移动,
故答案为:加快淀粉水解的速度(或起到催化剂的作用);
(2)冷凝效果逆流效果好,冷凝水的进口是a进b出,混酸为65%HNO3与98%H2SO4的混合液,混合液溶于水放热,温度高能加快化学反应,硝酸能进一步氧化H2C2O4成二氧化碳,
故答案为:a;温度过高,硝酸浓度过大,导致H2C2O4进一步被氧化;
(3)淀粉遇碘变蓝色,在已经水解的淀粉溶液中滴加几滴碘液或KI-I2溶液,溶液显蓝色,则证明淀粉没有完全水解;溶液若不显色,则证明淀粉完全水解,
故答案为:碘水或KI-I2溶液;
(4)减压过滤与常压过滤相比,优点:可加快过滤速度,并能得到较干燥的沉淀,装置特点:布氏漏斗与吸滤瓶配套,用于无机制备中晶体或粗颗粒沉淀的减压过滤,安全瓶、抽气泵不作为主要仪器,布氏漏斗颈的斜口要远离且面向吸滤瓶的抽气嘴,并且安全瓶中的导气管是短进长出,
故答案为:布氏漏斗、吸滤瓶(安全瓶、抽气泵不作为主要仪器);
(5)用含硫酸的母液来吸收氮氧化物,会生成硝酸而重复使用,提高HNO3利用率;但也会造成吸收不充分,造成环境污染,
故答案为:提高HNO3利用率(或循环使用氮氧化物);NOx(或氮氧化物)吸收不完全;
(6)高锰酸钾溶液为紫红色,当达到滴定终点时,再滴入高锰酸钾溶液时,淡紫色不再褪去,草酸钠(Na2C2O4)溶于稀硫酸中,然后用酸性高锰酸钾溶液进行滴定,离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,n(KMnO4)=0.016L×0.0200mol•L-1=3.2×10-4mol,根据方程式可得:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
2 5
3.2×10-4mol 8×10-4mol
样品中二水合草酸的质量为m=8×10-4mol×126g/mol=8×126×10-4g=0.1008g,
则该草酸晶体样品中二水合草酸的质量分数为$\frac{0.1008g}{0.12g}$×100%=84%,
故答案为:无色;紫红色(或淡紫色);84%.
点评 本题考查了草酸的制取,把握实验的原理,熟练进行氧化还原计算是解答的关键,注意用结晶法分离固体混合物及其抽滤的实验操作,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 目前使用的元素周期表中,最长的周期含有18种元素 | |
| B. | 吸热且熵减的非自发反应在一定条件下也可以发生 | |
| C. | 浓硝酸具有强氧化性,常温下能够溶解铁 | |
| D. | 加过量难溶电解质MnS可除去MnCl2溶液中混有的Cu2+,说明MnS的溶解度小于CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 在H2SO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
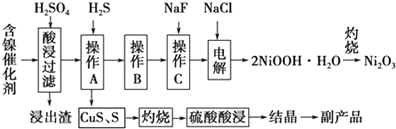
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
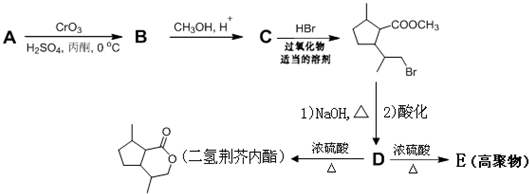
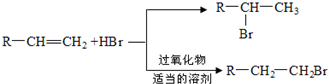
 ,D中含有的官能团的名称羧基、羟基.
,D中含有的官能团的名称羧基、羟基.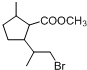 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$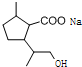 +CH3OH+NaBr.
+CH3OH+NaBr.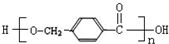 )的路线补全完整
)的路线补全完整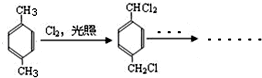
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合:c(H+)+C(CH3COOH)<C(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
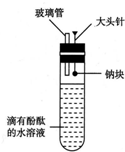 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:
有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3 NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com