
(11分)化合物X是制备Fe(OH)2过程(FeSO4+NaOH)中出现的绿色物质。取6.43g X,溶于酸,配成200mL溶液:①取出20.00mL,用0.0400mol/L的KMnO4溶液滴定,消耗20.00mL;②取出20.00mL,加入KI溶液,再用0.100mol/L的Na2S2O3溶液滴定,消耗20.00mL。
1.计算X中不同价态Fe的比例关系,并写出相应反应方程式;
2.通过计算和讨论确定该物质的化学式
3.写出制备X的总反应离子方程式。
1.5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(1分)
6.43g X中n(Fe2+)=10×5×0.04×0.02=0.04mol(1分)
2Fe3++3I-=2Fe2++I3- I2+2S2O32-=S4O62-+2I-(各0.5分)
6.43g X中n(Fe3+)=10×1×0.1×0.02=0.02mol
n(Fe2+)n(Fe3+)=21(1分)
2.如果X的式量为6.43/0.02=321.5,扣除3Fe后,余154,且阴离子共-7,即使全部为OH-也达不到154,因此有其它阴离子,只可能是SO42-,扣除96后,还余58(-5价),不难发现为2个OH-和1.5个O2-,X为Fe6(SO4)2(OH)4O3(5分)
3.12Fe2++O2+4SO42-+16OH-=2Fe6(SO4)2(OH)4O3+4H2O(1分)


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
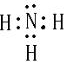
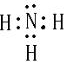
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
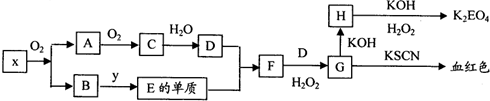
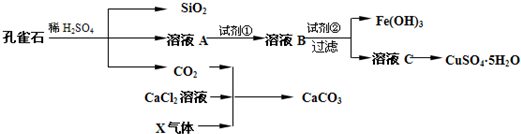 请回答下列问题:
请回答下列问题: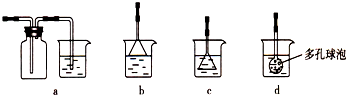
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
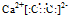
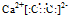
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com