

 ;②、④两种元素的原子按1:2组成的化合物为二氧化碳,其结构式为:O=C=O;
;②、④两种元素的原子按1:2组成的化合物为二氧化碳,其结构式为:O=C=O; ;O=C=O.
;O=C=O.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 Cu、Zn、稀H2SO4形成如图甲乙装置.
Cu、Zn、稀H2SO4形成如图甲乙装置.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
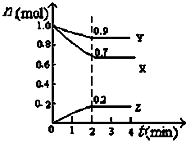 含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、SO3、Na2SO3、CuSO4、Na2SO4这7种常见的含硫化合物.回答下列问题:
含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、SO3、Na2SO3、CuSO4、Na2SO4这7种常见的含硫化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、 的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)有四种 的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)有四种 |
| B、C7H16的所有同分异构体中,分子中含有四个甲基的有五种 |
| C、某有机物的化学式为C4H8O3,现有0.1 mol该有机物分别与足量的钠、足量的碳酸氢钠溶液反应,生成标准状况下的气体分别为2.24 L H2、2.24 L CO2.则该有机物的同分异构体(不考虑立体异构) 共3种 |
| D、分子式为C4H10O并能发生酯化反应的有机物同分异构体有X种(不包括立体异构,下同),分了式为C5H10O并能发生银镜反应的有机物的同分异构体有y种,x>y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com