
下列说法正确的是( )
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.乙烯和1,3丁二烯互为同系物,它们均能使溴水褪色
C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
科目:高中化学 来源: 题型:
下面有关晶体的叙述中,不正确的是( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知:
①A++C-===D+E↑;②B++C-===2D。
请回答:
(1)C-离子的电子式是________________。
(2)A+离子中的键角为______________。
(3)分别写出A+和D反应、B+和E反应的离子方程式____________、____________。
(4)除D、E外,请再写出两种含10个电子的分子的分子式____________。
(5)除A+、B+外,请再写出两种含10个电子的阳离子________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的  ,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。
,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。
请回答下列问题:
(1)B单质的电子式是________。
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为____________________________。
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.甲苯是饱和烃,氯乙烯是不饱和烃
B.石油的裂化产品能使溴水褪色
C.蛋白质在CuSO4溶液中发生盐析
D.油脂在NaOH溶液中水解生成高级脂肪酸和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.油脂饱和程度越大,熔点越高
B.氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应
C.蔗糖、麦芽糖、硬脂酸甘油酯酸性水解都能得到2种物质
D.麻黄碱(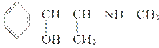 )的催化氧化产物能发生银镜反应
)的催化氧化产物能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某100 mL混合酸中,HNO3物质的量浓度为0.4 mol·L-1,H2SO4物质的量浓度为0.2 mol·L-1。向其中加入2.56 g Cu粉,待充分反应后(反应前后溶液体积变化忽略不计),溶液中Cu2+物质的量浓度为( )
A.0.15 mol·L-1 B.0.3 mol·L-1
C.0.225 mol·L-1 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3) /mol·L-1 | c(H2SO4) /mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时,探究温度对化学反应速率的影响,应选择__________(填实验编号);探究浓度对化学反应速率的影响,应选择__________(填实验编号);若同时选择①②③溶液测定变浑浊的时间,是探究__________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1 mol Na2S2O3转移 8 mol 电子,该反应的离子方程式是________________________________________________________________________。
甲同学设计如下实验流程探究Na2S2O3的化学性质。
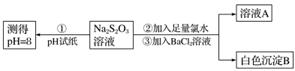
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是
________________________________________________________________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是________(填“甲”或“乙”),理由是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
下列有关说法正确的是( )
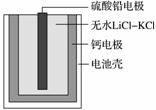
A.正极反应式:Ca+2Cl--2e-===CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com