
 、
、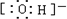 、
、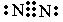 、
、 、
、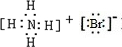 .
. 分析 (1)同周期元素的原子从左到右非金属的活泼性逐渐增强,对应的元素最高价氧化物的水化物的酸性逐渐增强;
(2)中子数=质量数-质子数,具有相同质子数、不同中子数的原子互为同位素;
(3)元素构成的双原子单质分子有三种,其式量分别为70、72、74,推断该元素存在两种同位素;依据两种同位素形成的三种单质的式量分析两种同位素的质量数为35、37;
(4)首先判断化合物是离子化合物还是共价化合物;依据电子式的书写写出,即把原子的最外层电子表示出来;若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
解答 解:(1)根据元素周期律:同周期元素从左到右非金属性逐渐增强,所以第三周期中,最活泼的非金属元素是Cl,最高价氧化物对应水化物为HClO4,
故答案为:氯;HClO4;
(2)中子数=质量数-质子数=3-2=1;${\;}_{2}^{3}$He与${\;}_{2}^{4}$He具有相同质子数、不同中子数,互为同位素,故答案为:1;同位素;
(3)元素构成的双原子单质分子有三种,其式量分别为70、72、74,推断该元素存在两种同位素;依据两种同位素形成的三种单质的式量分析两种同位素的质量数为35、37,故答案为:2;35、37;
(4)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,氢氧根离子中氢原子与氧原子间共用1对电子,电子式为:
,氢氧根离子中氢原子与氧原子间共用1对电子,电子式为: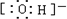 ;氮气分子中,两个氮原子共用3对电子,电子式为:
;氮气分子中,两个氮原子共用3对电子,电子式为: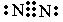 ;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键次氯酸的电子式为:
;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键次氯酸的电子式为: ;铵根离子为复杂阳离子,溴化铵是离子化合物,由氨根离子与溴离子构成,电子式为:
;铵根离子为复杂阳离子,溴化铵是离子化合物,由氨根离子与溴离子构成,电子式为: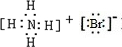 ,
,
故答案为: 、
、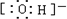 、
、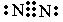 、
、 、
、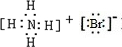 .
.
点评 本题考查了元素周期律、同位素和电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.


科目:高中化学 来源: 题型:填空题
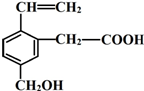 某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦
某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量CH3COONa固体 | D. | 改用98%的浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
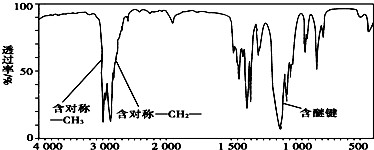
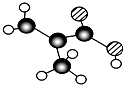 ,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).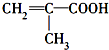 .
.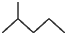 表示的有机物C的分子式为C6H14.
表示的有机物C的分子式为C6H14.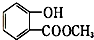 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
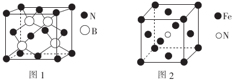
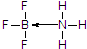 (标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.
(标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com