
| A. | F-和OH- | B. | Na+和Al3+ | C. | K+和Cl- | D. | Mg2+和S2- |
分析 粒子中质子数等于原子的质子数之和,中性微粒中质子数=电子数,阳离子的电子数=质子数-电荷数,阴离子的电子数=质子数+电荷数,以此解答.
解答 解:A.F-的质子数为9,电子数为9+1=10,OH-的质子数为9,电子数为9+1=10,电子数相同,故A不选;
B.Na+的质子数为11,电子数为11-1=10,Al3+的质子数为13,电子数为13-3=10,电子数相同,故B不选;
C.K+的质子数为19,电子数为19-1=18,Cl-的质子数为17,电子数为17+1=18,电子数相同,故C不选;
D.Mg2+的质子数为12,电子数为12-2=10,S2-的质子数为16,电子数为16+2=18,电子数不同,故D选.
故选D.
点评 本题主要考查微粒的质子数和电子数的关系,明确中性微粒、阳离子、阴离子的电子的数目计算是解答的关键,并注意中性微粒中质子数等于电子数.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
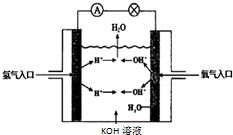 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若两元素原子序数相差8,则周期数一定相差1 | |
| B. | 两种简单离子不可能相差3个电子层 | |
| C. | 同族的两元素之间不可能形成化合物 | |
| D. | 最外层电子数相同的微粒一定位于同一族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气分子内每个氢原子都达到8电稳定结构 | |
| B. | 氢气分子的能量比氢原子的能量低 | |
| C. | 1molH2离解成2molH 要放出437.6kJ 热量 | |
| D. | 氢原子的还原性比氢分子的还原性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每摩尔Si晶体中,含有2摩尔Si-Si共价键 | |
| B. | 在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子 | |
| C. | 在CsCl晶体中,与每个Cs+周围紧邻的有8个Cl-,而与每个Cs+等距离紧邻的也有8个Cs+ | |
| D. | 在金刚石晶体中,最小碳原子环含有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①可能形成AgBr沉淀 | B. | ①一定能有效分离Cl-与Br- | ||
| C. | ②一定不能形成AgCl沉淀 | D. | ②一定能有效分离Cl-与Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下,在2L密闭容器中X、Y、Z三种气体进行反应,其物质的量随时间的变化曲线如图.
某温度下,在2L密闭容器中X、Y、Z三种气体进行反应,其物质的量随时间的变化曲线如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com