
ЁОЬтФПЁПЙЄвЕЩњВњжаГЃгУСЖаПЗЯдќЃЈКЌгаZnOЁЂFeOЁЂFe2O3ЁЂCuOЕШдгжЪЃЉРДЬсШЁбѕЛЏаПКЭН№ЪєЭЕШЃЌЦфжївЊЙЄвеСїГЬШчЭМЫљЪОЃК
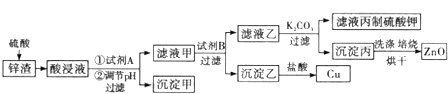
гаЙиЧтбѕЛЏЮяПЊЪМГСЕэКЭГСЕэЭъШЋЕФpHМћЯТБэ
ЧтбѕЛЏЮя | FeЃЈOHЃЉ3 | FeЃЈOHЃЉ2 | CuЃЈOHЃЉ2 | ZnЃЈOHЃЉ2 |
ПЊЪМГСЕэЕФpH | 1.5 | 6.5 | 5.4 | 6.5 |
ГСЕэЭъШЋЕФpH | 3.7 | 9.7 | 6.7 | 8.0 |
ЃЈ1ЃЉЮЊЬсИпНўГіЫйТЪЃЌГ§ЪЪЕБдіМгСђЫсХЈЖШЭтЃЌЛЙПЩВЩШЁЕФДыЪЉгаЃЈаДГіСНЬѕЃЉ ______
ЃЈ2ЃЉЪдМСAЪЧ ______ ЃЈЬюЛЏбЇЪНЃЉЃЎ
ЃЈ3ЃЉЕїНкЫсНўвКЕФpHЕФЗЖЮЇЪЧ ______.
ЃЈ4ЃЉТЫвКМзгыЪдМСBЗЂЩњжУЛЛЗДгІЃЌдђЪдМСBЪЧ ______ ЃЈЬюЛЏбЇЪНЃЉЃЎ
ЃЈ5ЃЉдкЪЕбщЪвНјааБКЩеЪБЃЌЪЂЗХГСЕэБћЕФвЧЦїУћГЦЪЧ ______ ЃЎ
ЁОД№АИЁПНСАшЁЂЪЪЕБЩ§ЮТЁЂНЋЗЯдќФыЯИГЩЗлФЉ H2O2 3.7ЁЋ5.4 Zn лслі
ЁОНтЮіЁП
ZnOЁЂFeOЁЂFe2O3ЁЂCuOгыСђЫсЗДгІЩњГЩСђЫсаПЁЂСђЫсбЧЬњЁЂСђЫсЬњвдМАСђЫсЭЃЌИљОнСїГЬЭМЃЌМгШыЪдМСAЕФФПЕФЪЧНЋбЧЬњРызгбѕЛЏЩњГЩЬњРызгЃЌБугкГСЕэЃЌвђДЫAПЩвдЮЊЫЋбѕЫЎЃЌЫЋбѕЫЎНЋЖўМлЬњРызгбѕЛЏЮЊШ§МлЬњРызгЃЌЕїНкpHЪЙFe(OH)3ЭъШЋГСЕэЃЌГСЕэМзЮЊЧтбѕЛЏЬњЃЛЮЊСЫВЛв§ШыаТдгжЪЃЌМгШыЪдМСBЃЌжУЛЛГіЭЃЌдђBЮЊаПЃЌгыСђЫсЭЗДгІЕУЕНЭЕЅжЪЃЛТЫвКввЮЊСђЫсКЭСђЫсаПЃЌМгШыЬМЫсМиЃЌгыСђЫсЗДгІЩњГЩСђЫсМиЃЌЭЌЪБЕУЕНГСЕэБћЬМЫсаПЃЌзЦЩеЕУЕНбѕЛЏаПЃЌОнДЫЗжЮіНтД№ЁЃ
(1)НСАшЁЂЪЪЕБЩ§ЮТЁЂНЋЗЯдќФыЯИГЩЗлФЉПЩМгПьЗДгІЫйТЪЃЌЙЪД№АИЮЊЃКНСАшЁЂЪЪЕБЩ§ЮТЁЂНЋЗЯдќФыЯИГЩЗлФЉЃЛ
(2)ЫЋбѕЫЎгыЖўМлЬњРызгЗДгІЕФРызгЗНГЬЪНЮЊЃКH2O2+2Fe2++2H+=2Fe3++2H2OЃЌЪЙЬњдЊЫиШнвзГСЕэЃЌЧвВЛв§ШыаТЕФдгжЪЃЌЙЪД№АИЮЊЃКH2O2ЃЛ
(3)ЪЙFe(OH)3ЭъШЋГСЕэЃЌЦфЫћРызгВЛГСЕэЃЌИљОнБэИёЪ§ОнЃЌЕїНкЫсНўвКЕФpHЕФЗЖЮЇЮЊЃК3.7ЁЋ5.4ЃЌЙЪД№АИЮЊЃК3.7ЁЋ5.4ЃЛ
(4)ИљОнЩЯЪіЗжЮіЃЌBЮЊаПЃЌЙЪД№АИЮЊЃКZnЃЛ
(5)БКЩеЙЬЬхгУлсліЃЌЙЪД№АИЮЊЃКлсліЁЃ


 гІгУЬтЕуВІЯЕСаД№АИ
гІгУЬтЕуВІЯЕСаД№АИ зДдЊМАЕкЯЕСаД№АИ
зДдЊМАЕкЯЕСаД№АИ ЭЌВНАТЪ§ЯЕСаД№АИ
ЭЌВНАТЪ§ЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщПЊеЙФЃФтЙЄвЕКЯГЩАБЕФжЦБИЪЕбщЃЌдк2 LУмБеШнЦїФкЃЌtЁцЪБЗЂЩњЗДгІЃКN2 (g)+3 H2 (g) ![]() 2 NH3 (g)ЃЌдкЬхЯЕжаЃЌn(N2)ЫцЪБМфЕФБфЛЏШчЯТБэЃК
2 NH3 (g)ЃЌдкЬхЯЕжаЃЌn(N2)ЫцЪБМфЕФБфЛЏШчЯТБэЃК
ЪБМф(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2ЕФЮяжЪЕФСП(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1) ЩЯЪіЗДгІдкЕк5minЪБЃЌN2ЕФзЊЛЏТЪЮЊ___________________ ЃЛ
(2) гУH2БэЪОДг0ЁЋ2 minФкИУЗДгІЕФЦНОљЫйТЪv(H2)=______________________ЃЛ
(3) tЁцЪБЃЌдк4ИіОљЮЊ2LУмБеШнЦїжаВЛЭЌЭЖСЯЯТНјааКЯГЩАБЗДгІЁЃИљОндкЯрЭЌЪБМфФкВтЖЈЕФНсЙћЃЌХаЖЯИУЗДгІНјааПьТ§ЕФЫГађЮЊ________________________(гУзжФИЬюПеЃЌЯТЭЌ)ЃЛ
aЃЎv(NH3)=0.05 mol L-1-min-1 bЃЎv(H2)=0.03 mol L-1-min-1
cЃЎv(N2)=0.02mol L-1-min-1ЁЁЁЁ ЁЁЁЁ dЃЎv(H2)=0.001 mol L-1- s -1
(4) ЯТСаБэЪіФмзїЮЊЩЯЪіЪЕбщжаПЩФцЗДгІN2 (g)+3 H2 (g) ![]() 2 NH3 (g) ДяЕНЛЏбЇЦНКтзДЬЌЕФБъжОЪЧ_________________________ ЃЛ
2 NH3 (g) ДяЕНЛЏбЇЦНКтзДЬЌЕФБъжОЪЧ_________________________ ЃЛ
a. ЗДгІЫйТЪv(N2)ЃКv(H2)ЃКv(NH3)=1ЃК3ЃК2
b. ИїзщЗжЕФЮяжЪЕФСПХЈЖШВЛдйИФБф
c. ЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйИФБф
d. ЛьКЯЦјЬхЕФУмЖШВЛБф
e. ЕЅЮЛЪБМфФкЩњГЩn mol N2ЕФЭЌЪБЃЌЩњГЩ3n mol H2ЁЃ
f. v(N2)ЯћКФ=2 v(NH3)ЯћКФ
g. ЕЅЮЛЪБМфФк3mol HЉHМќЖЯСбЕФЭЌЪБ2mol NЉHМќвВЖЯСб
(5) ЯТСаДыЪЉВЛФмЪЙЩЯЪіЛЏбЇЗДгІЫйТЪМгПьЕФЪЧ_____________ЁЃ
aЃЎМАЪБЗжРыГіNH3ЦјЬх bЃЎЪЪЕБЩ§ИпЮТЖШ
cЃЎдіДѓN2ЕФХЈЖШ dЃЎбЁдёИпаЇДпЛЏМС
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЬѕМўЯТЃЌжабЇЛЏбЇГЃМћЮяжЪМзЁЂввжЎМфДцдкШчЯТзЊЛЏЙиЯЕЃЌввЪЧ
![]()
A.HClB.NaHCO3 C.KOHD.FeCl2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬюПеЬтЁЃЧыЭъГЩвдЯТгаЙиМЦЫуЃК
(1)БъзМзДПіЯТЃЌm g AЦјЬхгыn g BЦјЬхЗжзгЪ§ЯрЕШЃЌ25ЁцЪБЃЌ1 kgЦјЬхAгы1 kgЦјЬхBЕФЗжзгЪ§жЎБШЮЊ________ ЁЃ
(2)m gФГMШмгкбЮЫсжаЃЌЗХГіЕФЦјЬхдкБъзМзДПіЯТЕФЬхЛ§ЮЊn LЃЌВЂЩњГЩТШЛЏЮяMCl2ЃЌдђН№ЪєMЕФЯрЖддзгжЪСПЪЧ________ЁЃ
(3)ШчЭМгаШ§жЛЦјЧђЃЌЦфжаVAЃНVBЃН1.12 LЁЃ
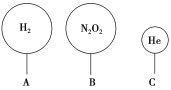
ЂйAЁЂBжаЦјЬхЕФЮяжЪЕФСП____(ЬюЁАвЛЖЈЁБЛђЁАВЛвЛЖЈЁБ)ЪЧ0.05 molЁЃ
ЂкБъзМзДПіЯТЃЌAЁЂBЦјЧђжаЕФЗжзгИіЪ§БШЮЊ_________ЁЃ
ЂлЯрЭЌЮТЖШКЭбЙЧПЯТЃЌAЁЂCЦјЧђжаЦјЬхЕФжЪСПЯрЕШЃЌдђV(A)ЁУV(C)ЃН__________
(4)ШЁ100 mL 0.3 molЁЄLЃ1КЭ300 mL 0.25 molЁЄLЃ1ЕФСђЫсзЂШы500 mLШнСПЦПжаЃЌМгЫЎЯЁЪЭжСПЬЖШЯпЃЌИУЛьКЯШмвКжаHЃЋЕФЮяжЪЕФСПХЈЖШЪЧ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкШчЭМЫљЪОЕФШ§ИіШнЛ§ЯрЭЌЕФШнЦїЂйЂкЂлжаНјааШчЯТЗДгІЃК3A(g)ЃЋB(g) ![]() 2C(g) ІЄH<0ЃЌШєЦ№ЪМЮТЖШЯрЭЌЃЌЗжБ№ЯђШ§ИіШнЦїжаЭЈШы3 mol AКЭ1 mol BЃЌдђДяЕНЦНКтЪБИїШнЦїжаCЮяжЪЕФЬхЛ§ЗжЪ§гЩДѓЕНаЁЕФЫГађЮЊЃЈ ЃЉ
2C(g) ІЄH<0ЃЌШєЦ№ЪМЮТЖШЯрЭЌЃЌЗжБ№ЯђШ§ИіШнЦїжаЭЈШы3 mol AКЭ1 mol BЃЌдђДяЕНЦНКтЪБИїШнЦїжаCЮяжЪЕФЬхЛ§ЗжЪ§гЩДѓЕНаЁЕФЫГађЮЊЃЈ ЃЉ
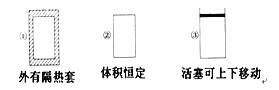
A. ЂлЂкЂйB. ЂлЂйЂкC. ЂйЂкЂлD. ЂкЂйЂл
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаПЛЙдЫФТШЛЏЙшЪЧвЛжжгазХСМКУгІгУЧАОАЕФжЦБИЙшЕФЗНЗЈЃЌИУжЦБИЙ§ГЬЪОвтЭМШчЯТЃК
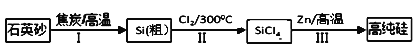
ЃЈ1ЃЉ1molНЙЬПдкЙ§ГЬЂёжаЪЇШЅ____molЕчзгЁЃ
ЃЈ2ЃЉЙ§ГЬЂђжаCl2гУЕчНтБЅКЭЪГбЮЫЎжЦБИЃЌжЦБИCl2ЕФРызгЗНГЬЪНЮЊ________ЁЃ
ЃЈ3ЃЉВНжшЃЈ2ЃЉжаЕФЕчНтЙ§ГЬжаЃЌШєгУМзДМШМСЯЕчГизїЕчдДЃЌгУKOHзїЕчНтжЪЃЌИКМЋЗДгІЮЊ_________ЁЃ
ЃЈ4ЃЉећЙ§ЩњВњЙ§ГЬБиаыбЯИёПижЦЮоЫЎЃЌЛиД№ЯТСаЮЪЬтЃК
ЂйSiCl4гіЫЎОчСвЫЎНтЩњГЩSiO2КЭвЛжжЫсЃЌЛЏбЇЗДгІЗНГЬЪНЮЊ_________ЁЃ
ЂкИЩдяCl2ЪБДггаРћгкГфЗжИЩдяКЭВйзїАВШЋЕФНЧЖШПМТЧЃЌашНЋдМ90ЁцЕФГБЪЊТШЦјЯШРфШДжС12ЁцЃЌШЛКѓдйЭЈШыХЈH2SO4жаЁЃРфШДЕФзїгУЪЧ_________ЁЃ
ЃЈ5ЃЉZnЛЙдSiCl4ЕФПЩФцЗДгІШчЯТЃК
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)ЁїHЃМ0ЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ___ЃЉ
Si(S)+2ZnCl2(g)ЁїHЃМ0ЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ___ЃЉ
AЃЎЛЙдЙ§ГЬашдкЮобѕЕФЦјЗежаНјаа |
BЃЎЭЖШы1molZnПЩЩњГЩ14gЛЙдВњЮя |
CЃЎдіМгSiCl4(g)ЕФСПЃЌИУЗДгІЦНКтГЃЪ§ВЛБф |
DЃЎШєSiCl4(g)Й§СППЩдіДѓЁїHЕФжЕ |
ЃЈ6ЃЉгавЛжжгЩЙшжЦзїЕФВФСЯжаГЃМгШыAg2SO4 ЃЌвбжЊФГЮТЖШЯТAg2SO4ЃЈMЃН312g/molЃЉЕФШмНтЖШЮЊ0.624g/100g H2OЃЌИУЮТЖШЯТAg2SO4ЕФKspЃН_______ЃЈСНЮЛгааЇЪ§зжЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯгУГрЬњПѓ(КЌFe2O3ЁЂFeOЃЌвВКЌгаAl2O3ЁЂMnO2ЁЂCuOЕШ)жЦБИFeSO4ЁЄ7H2O(ТЬЗЏ)ЕФСїГЬШчЯТЃК
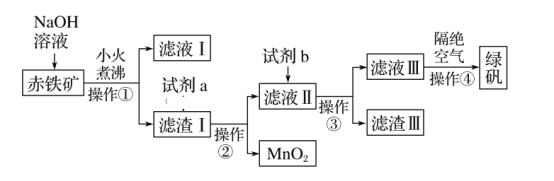
(1)ЪЕбщЪвжаВйзїЂйЕФУћГЦЮЊ____ЁЃЫљашЕФВЃСЇвЧЦїгаЩеБЁЂ______ЁЂ_____ЁЃ
(2)ЧтбѕЛЏФЦШмвКМгШыГрЬњПѓжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ_______________________ЁЃ
(3)МгШыТЫдќЂёжаЕФЪдМСaЪЧ___________ЃЌТЫвКЂђжаЕФжївЊН№ЪєбєРызгга_____ЁЃ
(4)ЪдМСbЮЊ__________________ЁЃ
(5)ТЫдќЂѓжаЕФжївЊГЩЗжЪЧ____________ЁЃВйзїЂмИєОјПеЦјЕФФПЕФЪЧ___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчБэЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌЦфжаУПИіЪ§зжБрКХДњБэвЛжжЖЬжмЦкдЊЫиЁЃ
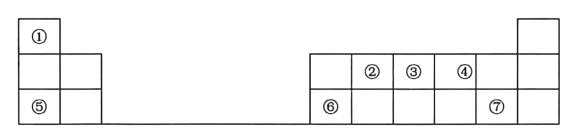
ЧыАДвЊЧѓЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉдЊЫиЂкЕФдЊЫиУћГЦЪЧ____ЁЃ
ЃЈ2ЃЉдЊЫиЂнДІгкжмЦкБэжаЕк____жмЦкЕк___зхЁЃ
ЃЈ3ЃЉЂйЂпЦпжждЊЫижадзгАыОЖзюДѓЕФЪЧ___ЃЈЬюдЊЫиЗћКХЃЉЁЃЂкЂлЂмШ§жждЊЫиЕФзюМђЕЅЧтЛЏЮяжазюЮШЖЈЕФЪЧ____ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ4ЃЉдЊЫиЂлКЭдЊЫиЂпЕФЧтЛЏЮяОљМЋвзШмгкЫЎЃЌЧвЖўепФмЗДгІВњЩњДѓСПАзбЬЃЌаДГіИУАзЩЋЮяжЪЗЂЩњЗжНтЕФЛЏбЇЗНГЬЪН______ЁЃ
ЃЈ5ЃЉдЊЫиЂоЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЪЧвЛжж____адЧтбѕЛЏЮяЃЌИУЮяжЪгыдЊЫиЂпЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЗДгІЕФРызгЗНГЬЪНЮЊ_____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПMgCO3КЭCaCO3ЕФФмСПЙиЯЕШчЭМЫљЪО(MЃНCaЁЂMg)ЃК
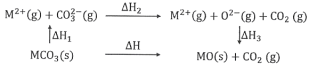
ЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.ЁїH1(CaCO3)>ЁїH1(MgCO3)>0
B.ЁїH2(MgCO3)>ЁїH2(CaCO3)>0
C.ЁїH1(CaCO3)ЃЁїH1(MgCO3)ЃНЁїH3(CaO)ЃЁїH3(MgO)
D.ЖдгкMgCO3КЭCaCO3ЃЌЁїH1ЃЋЁїH2>ЁїH3
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com