
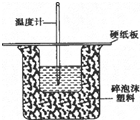
 50mL 0.5mol/L盐酸和50mL 0.55mol/L烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.5mol/L盐酸和50mL 0.55mol/L烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)为了保证酸全部反应,碱要稍过量;
(5)弱电解质电离吸热.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(4)NaOH的浓度大于HCl的浓度,使盐酸完全被中和,减少了盐酸挥发对实验的影响;
故答案为:确保盐酸完全反应;
(5)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替NaOH溶液反应,反应放出的热量偏小,中和热的数值偏小;
故答案为:偏小.
点评 本题考查学生有关中和热的测定,题目难度中等,注意理解中和热的概念和测定原理是解题的关键.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
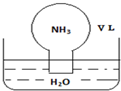 标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )| A. | 条件不足,不能计算所得溶液的物质的量浓度 | |
| B. | 所得溶液中,n(NH3•H2O)+n(NH4+)=$\frac{V}{22.4}$ mol | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 水最终不可能充满整个烧瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下,燃烧等物质的量的C2H4和乙醇,消耗O2体积不相同 | |
| B. | 分子式为C7H8O且属于酚类物质的同分异构体有4种 | |
| C. | 室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol/(L•s) | B. | v(A2)=0.5 mol/(L•s) | C. | v(C)=0.9 mol/(L•s) | D. | v(B2)=1.2 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
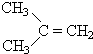 $→_{Zn/H_{2}O_{2}}^{O_{3}}$
$→_{Zn/H_{2}O_{2}}^{O_{3}}$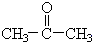 +
+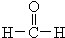 据以上线索和下列反应事实,确定C7H14的结构和名称:C7H14$→_{Zn/H_{2}O_{2}}^{O_{3}}$CH3CHO+
据以上线索和下列反应事实,确定C7H14的结构和名称:C7H14$→_{Zn/H_{2}O_{2}}^{O_{3}}$CH3CHO+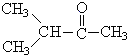
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物 干冰 SO2 | B. | 碱 苛性钠 NaOH | ||
| C. | 盐 钡餐 BaCO3 | D. | 单质 氯水 Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com